GRANDEURS NORMALES DU MYOCARDE
Concernant les dimensions cardiaques, les critères de normalité ne sont pas aussi simples que l’on pourrait le souhaiter.
Les valeurs normales des épaisseurs pariétales, des dimensions cavitaires et de la masse VG dépendent des méthodes de mesures utilisées. En échographie, malgré de nombreuses publications consacrées aux approches 2D et 3D, la mesure usuelle de la masse VG s’effectue toujours encore en mode TM selon les principes décrits en 1987 par Devereux [1], selon la convention de Penn ou selon les règles de l’ASE. Schématiquement, on peut considérer que l’épaisseur diastolique normale des parois myocardique est de 9 à 10 mm ; une épaisseur supérieure à 11-12 mm étant pathologique. Le diamètre normal du VG en incidence parasternal grand axe est en principe inférieur à 56 mm. Le poids du VG – normalement de l’ordre de 150-160 g – correspond approximativement à la moitié de la masse cardiaque globale. Il est d’usage d’exprimer la masse VG rapportée à la surface corporelle, quoique cette indexation soit criticable chez les sujet obèses (sous estimation de l’HVG alors ; une indexation par la taille^2.13 serait alors plus appropriée).
L’approche échographique TM de la masse VG (par exemple, selon Devereux MGV=1.04*((DVG+SIV+PP)^3-DVG^3)-13.6) suppose une géométrie ventriculaire ellipsoide et est donc très grossière et surtout très peu reproductible puisque toute erreur de mesure est elevée au cube par les calculs. La reproductibilité intra-observateur est faible (intervalle de confiance à 95% de l’ordre de 58 g pour un patient donné !) ; raison pour laquelle il n’est pas réaliste de pouvoir suivre l’évolution de la masse VG chez un même patient avec cette méthode. A titre indicatif, l’ordre de grandeur de la régression de la masse VG chez l’hypertendu hypertrophique traité par IEC ou anti-calcique est de l’ordre de 12 à 15%, soit environ 20 à 30 g. On comprend donc bien là l’intérêt d’une méthode de mesure plus précise et plus reproductible.
L’IRM permet de mesurer les volumes VG et la masse myocardique sans recourir à aucune supposition géométrique, en additionnant simplement les rondelles myocardiques obtenues tranche par tranche depuis la pointe jusqu’à la base du ventricule gauche (la mise en œuvre est décrite dans la section Méthodes/fonction). Malgré quelques variations dépendant du type de séquence utilisée, la masse VG ainsi obtenue est sensiblement plus petite que celle indiquée par l’échographie TM. La limite supérieure de masse VG en IRM est de l’ordre de 95 à 100 g/m2 alors qu’en échographie elle est de l’ordre de 120 g/m2 (134 g/m2 chez l’homme et 110 g/m2 hez la femme [2]). Il importe donc de bien distinguer les normes échographiques et les normes IRM lorsqu’on considère les résultats d’un patient donné car les mesures ne sont pas interchangeables…
On retiendra donc en pratique :
| NORMES | ECHO TM | IRM (ciné petit axe SSFP) |
| Parois (SIV, PP) | <11-12 mm | <11-12 mm |
| Diamètre VG | < 56 mm | 4 cavités < 56 mm et vertical grand axe <60 mm |
| Masse VG (g/m2) | <130 (homme) et <110 (femme) | <100 (homme) et < 95 (femme) |
DISTINCTION ENTRE CŒUR D’ATHLÈTE ET CMH
Chez le sujet jeune sportif le diagnostic différentiel peut se poser entre cardiomyopathie hypertrophique et HVG physiologique de l’athlète. En principe, l’hypertrophie du sportif est proportionnelle et harmonieuse mais une certaine asymétrie (prédominance septale) peut soulever le doute quant à la nature physiologique de l’HVG.
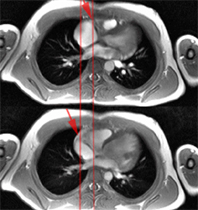
Les sports d’endurance (jogging…) entrainent des hypertrophies essentiellement excentriques (distension du diamètre VG avec peu d’hypertrophie des parois et rapport h/r restant < 0.4). On considère qu’une épaisseur pariétale supérieure à 13 mm est rare et une épaisseur pariétale supérieure à 15 mm est jusqu’à preuve du contraire (régression à l’arrêt du sport) en faveur d’une cause pathologique d’hypertrophie . Par exemple, chez les cyclistes du tour de France étudiés par Abergel [3], le diamètre échographique moyen du VG était de 60,1 mm et l’épaisseur pariétale dépassait rarement 13 mm chez l’homme ou 12 mm chez la femme.
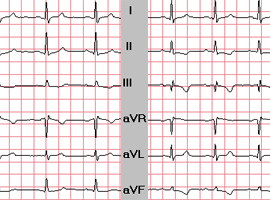
Les troubles de repolarisation ECG constituent une aide complémentaire précieuse. Ils ne doivent pas être considérés comme physiologiques mais doivent faire suspecter une cardiomyopathie car leur signification est péjorative (Pelliccia 2008 [4]). Les critères de discrimination entre HVG physiologique et pathologique, résumés dans le tableau ci-dessous, sont détaillés par Maron en 2005 [5] et dans les recommandations de la SFC [6].
| INDICATEURS | COEUR D’ATHLÈTE | CMH |
| CMH ou mort subite familiale | – | +++ |
| Symptomatologie d’effort (dyspnée, palpitations) | – | ++ |
| Anomalies ECG (inversion T, ondes Q, ES) | – | ++ |
| VG < 45mm, gros septum (SIV/PP>1,5) | – | ++ |
| Anomalies diastoliques si < 40 ans | – | ++ |
| VO2 faible, inadaptation à l’effort | – | ++ |
| Persistance HVG après déconditionnement | – | +++ |
| Test génétique positif | – | +++ |
Un autre critère intéressant qui permetrrait de discriminer avec une sensibilité de 80% et une spécificité de 99% les coeurs d’athlète vs cardiomyopathies a été proposé par Petersen en 2005 [7] : épaisseur pariétale/volume diastolique. Des valeurs < 0.15 mm/m2/ml irait à l’encontre d’une cardiomyopathie.
LES ATOUTS DE L’IRM
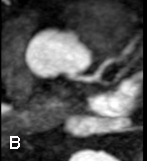
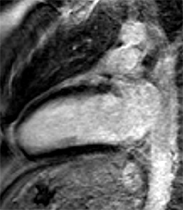
Avec l’IRM, la distribution de l’hypertrophie est mieux analysée qu’en échographie et la masse VG peut être fiablement quantifiée. Certains pièges échographiques conduisant à des surestimations pariétales (par exemple faux tendons illustré ci-dessus ou trabéculation du VD) peuvent être évités et a contrario certains segments hypertrophiés mal visibles en échographie sont mieux identifiés en IRM ; raison pour laquelle la masse VG est plus élevée qu’en échographie dans ces situations d’hypertrophie segmentaire [8].
Enfin et surtout, des plages de rehaussement tardif post-gadolinium, présentes dans 80% environ des CMH [9] (et chez certains patients avec rétrécissements aortiques) sont toujours absentes en cas d’hypertrophie myocardique du sportif (Hansen 2007(b) [10] ).
 |
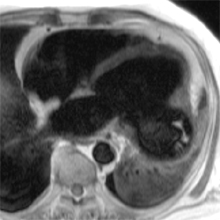
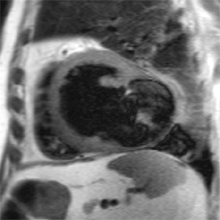
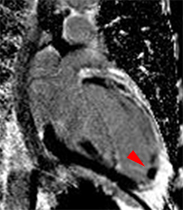
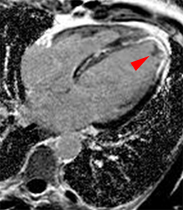
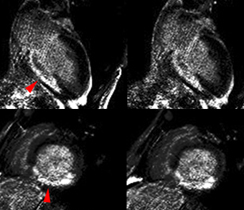
EXEMPLES EN IRM
COEUR D’ATHLETE (SAIN)
CARDIOMYOPATHIE (PATHOLOGIQUE)
 |
 |
||
| ciné vertical grand axe | T1 post-gadolinium | ciné 4 cavités | T1 post-gadolinium |
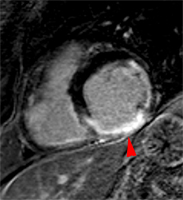
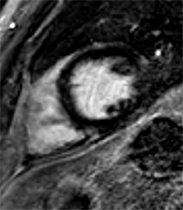
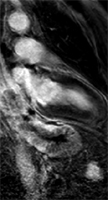
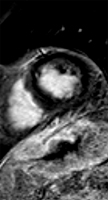
Exemple de cardiomyopathie hypertrophique chez un patient de 45 ans, sportif. VG diastolique 105 ml/m2, FEVG 70%, masse VG 126 g/m2 (N<100). Les hypersignaux en mottes intra-myocardiques sur les images T1 post-gadolinium (flèches) signent la présence de plages de fibrose myocardique pathologique correspondant à la cardiomyopathie.