Dans les CM infiltratives, le myocarde est infiltré par des dépôts pathologiques liés à des affections acquises (amylose) ou congénitales (Maladies de Gaucher, de Hurler, de Hunter), entrainant un tableau cardiaque proche de celui des maladies de surcharges (section suivantes).
AMYLOSE
L’amylose est caractérisée par des dépots extracellulaires de proteines homologues complexes. Son pronostic est sévère. Le diagnostic histologique est basé sur la mise en évidence des dépots amyloide amorphes comprimant les cardiomyocytes, apparaissant sous forme d’une biréfringence verte à l’examen de biopsies tissulaires en lumière polarisée après coloration au rouge congo. Trois formes sont répertoriées selon le type de protéine fibrillaire incriminée :
– AL constitué de chaines legères d’immunoglobulines monoclonales (amylose primaire) avec atteinte cardiaque dans 50% des cas et défaillance cardiaque fréquente.
– ATTR constituée de transthyrétine plasmatique normale (amylose systémique sénile), impliquant fréquemment le coeur.
– AA constituée de protéines plasmatiques amyloides A, survenant dans le cadre de maladies inflammatoires chroniques (amylose secondaire).
La présentation habituelle correspond à une hypertrophie myocardique plutôt concentrique qu’asymétrique, qui contraste avec des petits voltages ECG discordants (Sokolow faible). La cinétique systolique est généralement altérée et les anomalies de remplissage sont fréquentes (profil restrictif). Des thrombi muraux notamment auriculaires sont possibles. Des épanchements péricardiques et pleuraux sont souvent observés.
La séméiologie IRM des amyloses cardiaques primitives et secondaires a été bien décrite par Van Geluwe 2006 [1]. et Hansen 2007(b) [2]. Des épaississements nodulaires (>6mm) de la paroi libre de l’OD et du septum auriculaire peuvent être observés (Fattori 1998 [3]).
Le rehaussement tardif post gadolinium a été étudié dans plusieurs cas isolés (Cueno 2006 [4], Cheng [5], Sueyoshi 2006 [6], Leeson 2006 [7]) et dans de plus larges séries (Vanden Driesen 2004 [8]).
Pour Perugini 2006 [9] , des plages de rehaussement tardif post-gadolinium sont observées chez 76% des patients qui présentent une amylose systémique avec signes échographiques d’atteinte cardiaque : épaisseur septale diastolique > 12 mm, épaississement homogènes des valves AV, épaississement du septum auriculaire, aspect hyperéchogène brillant (sparkly, granular or speckled appearance) du septum interventriculaire. Les régions médio-ventriculaires sont le plus fréquemment atteintes.
Un rehaussement tardif sous endocardique diffus est retrouvé chez 69% des patients par Maceira 2005 [10] , correspondant à un T1 significativement abaissé dans ces territoires. Une distribution caractéristique est représentée par l’aspect ‘en zèbre’ comportant une couche sous endocardique (plus ou moins circonférentielle) et une ligne d’hypersignal sous épicardique séparées par une zone en hyposignal médioparétale. Les autres parois myocardiques (VD, oreillettes) apparaissent également volontiers en hypersignal. La présence d’un hypersignal est très sensible pour identifier une atteinte cardiaque en cas d’amylose systémique et est corrélé à l’élévation du BNP mais n’a pas de valeur pronostic sur le mortalité (Ruberg 2009 [11]).
Un élément caractéristique, spécifique, dans cette affection est la difficulté voire l’impossibilité de régler le TI correctement pour discriminer le myocarde du poool sanguin en raison des perturbations de la cinétique du gadolinium (retenu en grande quantité par les dépôts amyloides cardiaque, alors qu’il est éliminé plus rapidement du pool sanguin). Les séquences de TI scout (ou Look-Locker) ont une véritable valeur diagnostique ici car elles montrent que le myocarde se noirci pour des valeurs de TI plus courtes que celles du pool sanguin (early myocardial nulling, Syed-Araoz RSNA 2007). La repousse du signal s’effectue plus vite pour le myocarde que pour le sang (cf: voir illustrations ci-dessous).
Pour Krombach 2007 [12] , la mesure du T1 myocardique de base (sans injection de gadolinium) permettrait également d’identifier les conséquences des infiltrats interstitiels par des dépôts amyloides car le T1 serait alors significativement plus élevé (1387 ms en cas d’amylose vs 1083 ms normalement).
Exemples d’amylose cardiaque
 |
 |
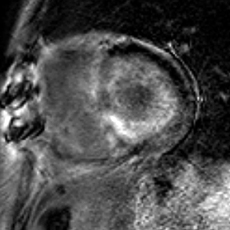 |
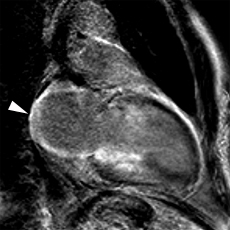
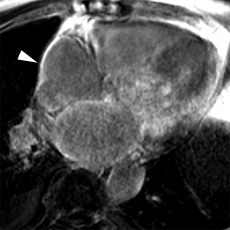
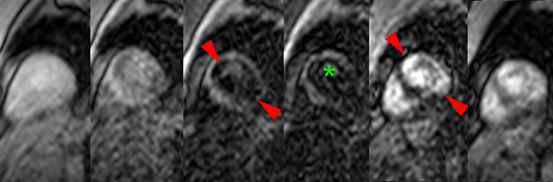
Patient de 80 ans présentant une insuffisance cardiaque d’allure restrictive avec HVG et épanchement pleural droit. Hypersignal post-gadolinium hétérogène, prédominant en inférieur, intéressant également les parois des oreillettes (flèches blanches).
 |
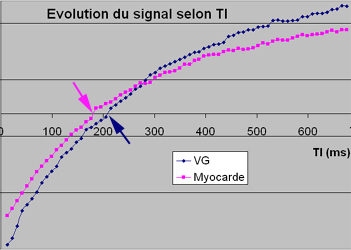 |
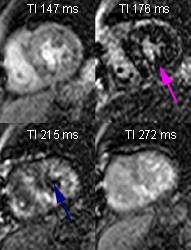
Intérêt de la séquence Look-Locker qui montre une annulation du signal myocardique qui précède l’annulation du signal du sang. Les courbes de repousse de l’aimantation longitudinale obtenues dans le septum (violet) et dans le VG (bleu) montrent que le signal du myocarde traverse la ligne du zéro (flèche violette) pour un TI de 176 ms alors que le sang traverse la ligne du zéro (flèche bleue) pour un TI plus long de 215 ms. Le T1 du myocarde est plus court que le T1 du sang. Ce comportement, inversé par rapport à la normale, est quasi pathognomonique de l’amyloes myocardique et en constitue le meilleur indice diagnostique.
 |
 |
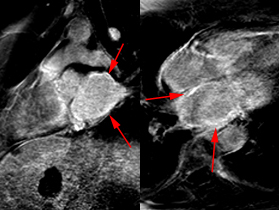 |
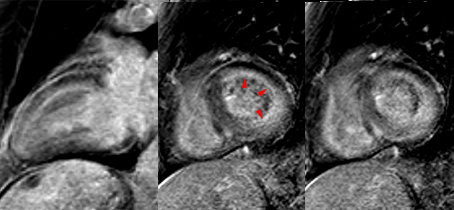
Bilan de myélome à chaine légères libres lambda chez une patient de 72 ans avec découverte échographique d’une HVG concentrique (cf: ciné en coupe 4 cavités). Après injection de gadolinium, on observe sur les images de la séquence Look-Locker (en haut à droite) un noircissement de certaines plages myocardiques (flèches rouges) pour des valeurs de TI plus précoces que le noircissement du pool sanguin (étoile verte), ce qui traduit un raccourcissement du T1 myocardique plus prononcé que le raccourcissement du T1 sanguin. Pour des valeurs de TI plus élevées, le signal myocardique reste par endroit plus intense que le signal sanguin. Ce comportement du signal est caractéristique et quasi spécifique en faveur d’une amylose cardiaque. Sur les séquences de rehaussement tardif (ligne du bas), on observe de larges segments d’hypersignal sous endocardique presque circonférentiels (tète de flèche), ne répondant pas à une distribution coronaire, avec par endroit un liseré d’hypersignal sous épicardique (aspect en zèbre). Noter également le rehaussement de signal de la paroi de l’oreillette gauche (flèches longue) également évocateur en faveur d’une amylose.