La maladie coronaire constitue le principal chapitre de la cardiologie et occupe plus de la moitié du temps de travail en pratique courante. Le sujet est très vaste ; raison pour laquelle nous nous concentrerons surtout sur les apports singuliers de l’IRM, dominés par la visualisation de l’infarctus grâce à l’imagerie T1 post-gadolinium.
Coeur
| COEUR NORMAL |
| COEUR NORMAL Plans_coupe Incidences_obliques Retour_veineux_systemique Voie_droite absence de rehaussement tardif post-gadolinium Petites structures anatomiques : |
 |
| Antommarchi, Francesco. Planches anatomiques du corps humain, exécutées d’après les dimensions naturelles accompagnées d’un texte explicatif – Paris : à l’imprimerie lithographique de C. de Lasteyrie, [1826]. BIUM [1] |
FONCTION VENTRICULAIRE
Introduction– Pourquoi recourir à l’IRM pour évaluer la fonction VG ? Ventricule gauche– Méthodes de mesures du VG Ventricule droit– Evaluation du coeur droit |
 |
| Gautier d’Agoty, Jacques, 1717-1786Anatomie générale des viscères en situation, de grandeur et couleur naturelle, avec l’angéologie, et la névrologie de chaque partie du corps humain. Réf : [[1]] |
Ventricule droit à double issue
VDDI
 |
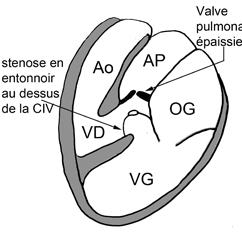
(Schéma extrait de Kastler 2001 [1]) |
 |
 |
|
 |
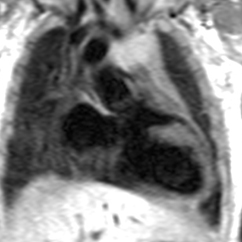 |
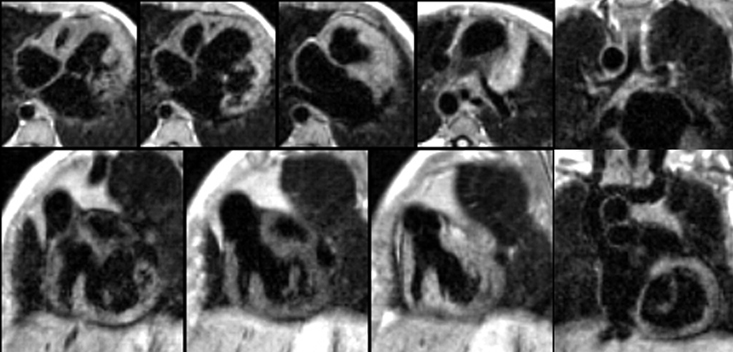
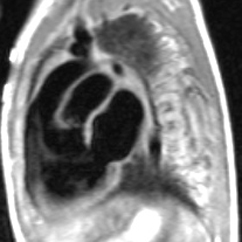
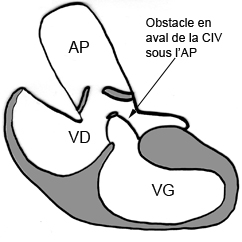
Exemple de ventricule droit à double issue (VDDI) chez un nouveau né de 24 jours. Les deux gros vaisseaux qui sont transposés (Ao en avant et AP en arrière) naissent à la partie supérieure du VD et chemine parallèlement (en canon de fusil). Le VG est situé en dessous du VD avec lequel il communique par une CIV. Il existe un jet de perte de signal systolique au dessus du defect de CIV correspondant à un obstacle de type diaphragme ou membrane percée situé juste en dessous de l’orifice pulmonaire. La résolution spatiale limitée et le jet de perte de signal ne permettent pas ici de distinguer clairement la possible participation d’une sténose valvulaire pulmonaire associée chez ce jeune patient. On notera à ce sujet l’avantage certain du scanner pour une analyse anatomique fine de ce type de problème (obstacle sous valvulaire sous forme de diaphragme ou de membrane .
ATRESIE TRICUSPIDE
 |
Atrésie tricuspide(Schéma extrait de Kastler 2001 [1]) |
Atrésie tricuspide chez le nourisson
Atrésie tricuspide avec transposition des gros vaisseaux, large CIV et crosse aortique droite
Shunt de Blalock droit palliatif pour atrésie tricuspide
Dilatation majeure des réseaux cave superieur et inférieur, reprise des artères pulmonaires droite et gauche (flèches blanches) grace à un shunt de Blalock droit (fleche rouge).
Dérivation cavo-pulmonaire pour atrésie tricuspide
 |
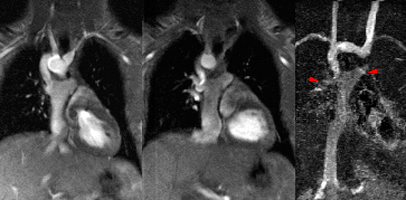 |
La figure de droite illustre une dérivation bi-cavo-pulmonaire pour atrésie tricuspide. Sur l’acquisition angio-IRM tardive (avec gadolinium) à droite, les flèches rouges indiquent le raccordement aux artères pulmonaires droite et gauche. Le schéma de gauche est extrait de Kastler 2001 [1]).
 |
| Réévaluation d’une intervention de Fontan pour atrésie tricuspide chez un garçon de 14 ans. Aorte située en avant des artères pulmonaires, coiffant un ventricule gauche dilaté, normokinétique.Du côté droit : le drainage veineux cave inférieur est assuré par un tube vertical de 15 mm de diamètre, situé en avant de l’aorte descendante (qui est positionnée à droite). Ce tube se raccorde avec le tronc pulmonaire où se raccorde également à la partie supérieure, la veine cave supérieure d’un calibre de 11 mm. Le calibre des branches pulmonaires est normal. |
intervention de Fontan pour atrésie tricuspide
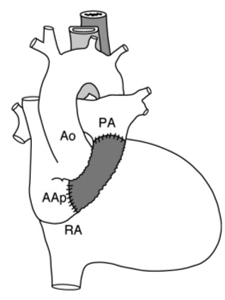 |
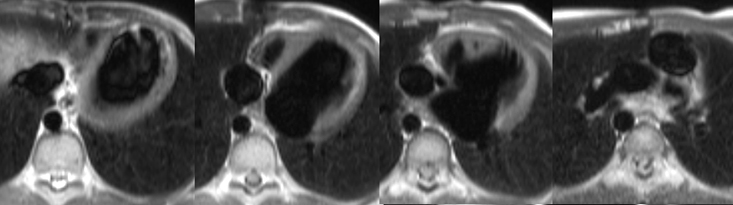
Intervention de Fontan pour atrésie tricuspideTube entre l’auricule droite et le tronc de l’artère pulmonaire.
(Schéma extrait de Kastler 2001 [2]) |
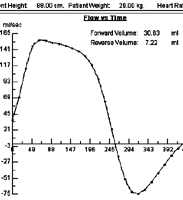 |
Enfant de 3 ans présentant un tube prothétique de 13 mm de diamètre, connecté à l’oreillette droite (diamètre 28mm), passant à droite de la racine aortique et se raccordant au tronc de l’artère pulmonaire. La voie droite est bien perméable mais il existe un reflux pulmonaire relativement important (inversion de teinte en diastole sur les ciné de cartographie de flux). Le flux antegrade est de 30 ml vs flux retrograde de 7 ml, soit une fraction de régurgitation de l’ordre de 25%.
Maladie d’Ebstein
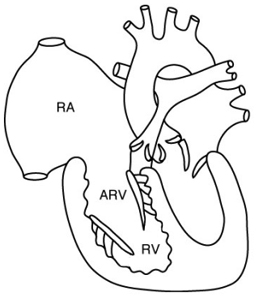 |
La maladie d’Ebstein est caractérisée par un déplacement vers le bas et l’avant de l’insertion du feuillet septal de la tricuspide, à mi distance environ du septum interventriculaire.Il en résulte un défaut de continence valvulaire grave car les feuillets tricuspidiens sont excentrés l’un par rapport à l’autre (flèches ci-dessous).
Cette malformation congénitale délimite en avant une chambre ventriculaire apicale, au milieu une chambre atrialisée du VD et en arrière l’oreillette droite véritable qui est très dilatée. (Schéma extrait de Kastler 2001 [1]) |
 |
 |
|
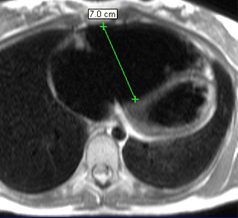
Exemple typique de Maladie d’Ebstein avec dilatation majeure du diamètre du ventricule droit sous tricuspidien (70 mm ici) et défaut grossier d’apposition des feuillets valvulaires tricuspidiens (flèches rouges). La fuite tricuspide est massive, non pas turbulente mais ‘laminarisée’, avec des vitesses peu élevées n’entrainant pratiquement pas de jet de perte de signal sur ces séquences SSFP.
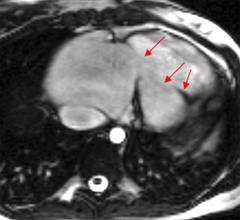
Autre exemple de maladie d’Ebstein avec fuite tricuspide massive. L’analyse quantitative de la fuite par cartographie des flux est illustrée dans la section consacrée aux fuites tricuspides.
TRANSPOSITION CORRIGÉE DES GROS VAISSEAUX
Transposition corrigée des gros vaisseaux
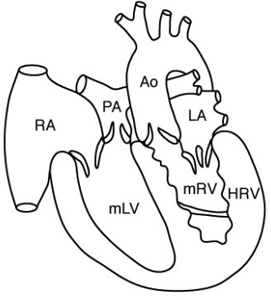 |
La transposition corrigée des gros vaisseaux correspond à une double discordance :1) des gros vaisseaux (discordance ventriculo-artérielle), et
2) des ventricules (discordance auriculo-ventriculaire). En l’absence d’autre anomalies anatomique, les circuits droit et gauche sont ainsi respectées et le patient peut rester asymptomatique. Des lésions associées sont cependant fréquentes, notamment valvulaires (sténose pulmonaire – cf: ci-dessous) ou à type de CIV et les troubles du rythme sont fréquents. (Schéma extrait de Kastler 2001 [1]) |
Deux indices permettent de reconnaitre l’inversion ventriculaire :
1) la valve auriculo-ventriculaire située en arrière est la valve mitrale et communique avec un ventricule anatomiquement gauche tandis que la valve située plus en avant est une valve tricuspide qui communique avec un ventricule droit. Un plan de coupe horizontal (± oblique) permet en général de visualiser l’implantation septale des valves auriculo-ventriculaires et ainsi d’identifier celle qui est disposée en arrière de l’autre (c’est à dire la valve mitrale). Une illustration de ces dispositions est donnée dans la section consacrée aux valves cardiaques.
2) le deuxième indice concerne l’aspect du ventricule, car le ventricule anatomiquement gauche est moins trabéculé que le ventricule anatomiquement droit (qui est barré par la bandelette ansiforme) et comporte une continuité entre la valve d’entrée et la valve de sortie.
 La double discordance est bien reconnaissable sur cette planche. On observe une aorte (Ao.) naissant à gauche de l’artère pulmonaire. Les gros vaisseaux cheminent parallèlement (canon de fusil), sans se croiser. Le ventricule situé à gauche est trabéculé avec présence d’une bandelette ansiforme (flèche blanche). Il s’agit d’un ventricule ‘droit’ situé à gauche, systémique, puisqu’il est en dessous de l’aorte. La valve A-V située du coté gauche est une valve tricuspide (flèche rouge) car son implantation s’effectue en avant de l’implantation de la valve A-V située à doite (flèche bleue – qui est donc une valve mitrale, communicant avec un ventricule ‘gauche’ située à droite et pompant vers l’artère pulmonaire).
La double discordance est bien reconnaissable sur cette planche. On observe une aorte (Ao.) naissant à gauche de l’artère pulmonaire. Les gros vaisseaux cheminent parallèlement (canon de fusil), sans se croiser. Le ventricule situé à gauche est trabéculé avec présence d’une bandelette ansiforme (flèche blanche). Il s’agit d’un ventricule ‘droit’ situé à gauche, systémique, puisqu’il est en dessous de l’aorte. La valve A-V située du coté gauche est une valve tricuspide (flèche rouge) car son implantation s’effectue en avant de l’implantation de la valve A-V située à doite (flèche bleue – qui est donc une valve mitrale, communicant avec un ventricule ‘gauche’ située à droite et pompant vers l’artère pulmonaire).
Transposition corrigée avec sténose sous valvulaire pulmonaire
 |
Noter l’emplacement septal des valves auriculo-ventriculaires (grosses tètes de flèches blanches). La valve située du coté droit est positionnée en arrière de la valve controlatérale, il s’agit donc d’une valve mitrale communiquant avec un ventricule anatomiquement gauche qui éjecte vers la zone sous pulmonaire sténosée (flèche mince bleue). L’artère pulmonaire se situe en arrière de la racine aortique avec aspect typique en « canon de fusil » des gros vaisseaux sur l’incidence sagittale. La valve AV située du coté gauche est plus antérieure ce qui signifie qu’il s’agit d’une valve tricuspide communiquant avec un ventricule anatomiquement droit qui éjecte vers une aorte située en avant du tronc pulmonaire (flèche mince rouge).
Transposition corrigée avec CIV
| Discordance A-V (mitrale et VG à D, tricuspide et VD à G) | CIV sous pulmonaire – jet de shunt G-D | Gros vaisseaux transposés (parallèles) | Flux pulmo: 156, flux Ao: 73 – Qp/Qs 2.1 |
TGV / INTERVENTIONS DE SENNING-MUSTARD
Intervention de Senning
L’intervention de Senning consiste a rediriger le drainage veineux pulmonaire vers l’oreillette droite et à rediriger les retours caves supérieur et inférieur vers l’oreillette gauche. Il s’agit d’une variante de l’intervention de Mustard.
 |
Redirection des retours veineux systémique et pulmonaire selon Senning (Schéma extrait de Kastler 2001 [1]) |
Exemples :
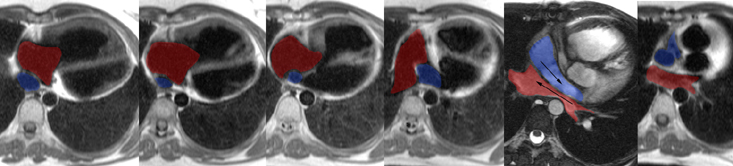 |
Examen IRM de simple surveillance chez une patient de 24 ans, ayant bénéficié à l’age de un an d’une intervention de Senning pour TGV. Redirection des retours veineux avec canalisation des retours cave inférieur et cave supérieur vers l’OG à travers un tunnel de 13 à 14 mm de diamètre, bien perméable (dessiné en bleu). Redirection des retours veineux pulmonaires vers l’OD (dessiné en rouge) avec aspect légèrement pincé du fond de l’ancienne OG contre le bord antérieur de l’aorte (calibre minimal 6 mm) mais sans dilatation des veines pulmonaires gauches. Aspect dilaté et hypertrophié du VD qui reste normokinétique (diamètre diastolique 44 mm, épaisseur de la paroi libre antérieure du VD 9 mm, volume diastolique 90 ml et FE 65 %). Il existe une fuite tricuspide nette. Débits éjectionnels droit et gauche similaires

Patient de 27 ans aux antécédent d’intervention de Senning à l’age de 10 mois, présentant une HTAP. L’examen IRM montre que le montage de Senning fonctionne correctement (retour veineux systémique marqué par une étoile bleue, redirigé vers l’OG et circuit veineux pulmonaire marqué par une étoile rouge dévié vers l’OD). Il existe une forte dilatation du ventricule gauche sous-pulmonaire, du tronc et des branches proximales de l’artère pulmonaire ainsi qu’une fuite pulmonaire de 30% (en cartographie des flux). Ces éléments sont concordant avec l’HTAP mais il n’y a pas d’indice pour expliquer cette HTAP (et notamment pas de shunt puisque les débits éjectionnels droit et gauche sont identiques à 50 ml/ cycle ni de canal artériel persistant.
Senning Partiel
 |
TRANSPOSITION DES GROS VAISSEAUX
 |
 |
Croquis correspondant à la transposition des gros vaisseaux ‘simple’ (à gauche) et avec CIV / sténose pulmonaire (à droite).(Schéma extrait de Kastler 2001 [1]) |
| La transposition des gros vaisseaux (TGV) n’est pas une affection viable à très brève échéance après la naissance car les circuits droit et gauche sont refermés sur eux même ; raison pour laquelle l’intervention de Rashkind est réalisée en période néonatale.Chez l’adulte, cette affection peut se rencontrer dans deux types de situations :
1) TGV opérée, soit par redirection des retours veineux (Mustard – Senning), soit – depuis 1985 – par intervention de détransposition (switch artériel avec réimplantation des coronaires). 2) Transposition ‘corrigée’ des gros vaisseaux ou double discordance qui associe une inversion des raccords auriculo-ventriculaires et des jonctions ventriculo-artérielles. Ci-contre, image pathognomonique de la transposition des gros vaisseaux avec aspect de ‘canon de fusil’ en coupe sagittale montrant l’aorte en avant et l’artère pulmonaire en arrière cheminant parallèlement à l’aorte ascendante |
Transposition gros vaisseaux chez le nouveau-né
Atrésie pulmonaire avec CIV
L’atrésie pulmonaire avec CIV constitue une forme d’hyper-Fallot imposant rapidement un apport de vascularisation sanguine pulmonaire, en maintenant le canal artériel ouvert, en effectuant une dérivation de type Blalock-Taussig ou en reconstituant une voie droite efficace.
 |
 |
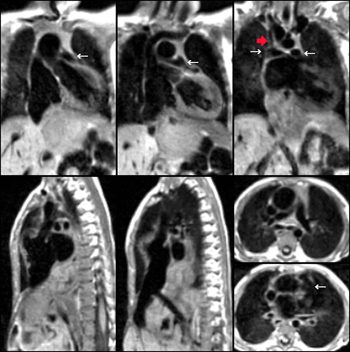
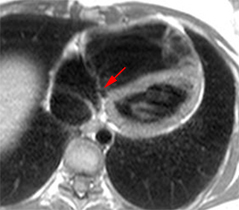
La figure de droite montre une atrésie pulmonaire (flèche) à septum ouvert (non visible sur ce cliché) chez un enfant de 6 mois avec large canal artériel perméable (astérisque) et développement d’une circulation systémique de suppléance partant des artères bronchiques (tête de flèche). (Schéma de gauche extrait de Kastler 2001 [1]).
Évolution après patch infundibulaire
Examen initial, avant intervention d’élargissement de la voie droite :
Atrésie pulmonaire chez un enfant de 6 ans avec tube valvulé pulmonaire trop petit . HVD (ventricule droit ‘de lutte’, plus large que le VG, hypertrabeculé), sévère hypoplasie infundibulaire et du tronc de l’artère pulmonaire. Branches pulmonaires droite et gauche de petit calibre (avec stent sur l’AP gauche).
Deuxième examen après mise en place d’un patch infundibulaire :
La mise en place du patch (flèches rouges) a permis de restituer un pseudo infundibulum et un tronc de l’artère pulmonaire de bon calibre. Présence d’un stent sur la branche gauche de l’artère pulmonaire (flèche blanche).