Les cardiomyopathies hypertrophiques (CMH) – voir document de consensus de ACC et de l’ESC de 2003 [1]-, caractérisées par une hypertrophie des parois avec petite cavité VG, sont reconnues comme des maladies génétiques autosomiques dominantes dont la prévalence n’est pas exceptionnelle : 1/500. Elles sont impliquées aux USA comme la première cause de mort subite chez les patients jeunes (en Europe la dysplasie du VD serait l’étiologie dominante). L’expression phénotypique peut être très variable et l’apparition de signes ECG ou morphologiques peut être retardée à l’âge adulte.
 |
Les parois du VG sont hypertrophiées, sans dilatation cavitaire et sans étiologie de type HTA ou sténose aortique.Des anomalies ECG peuvent attirer l’attention mais c’est surtout l’échocardiographie qui fait le diagnostic.
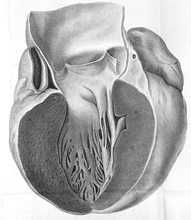
Le polymorphisme est important avec une atteinte généralement asymétrique, impliquant le septum 8 fois sur 10. Le diagnostic est évoqué lorsque l’épaisseur des parois dépasse 15 mm en dehors de toute hérédité connue et de 13 mm dans un contexte de CMH familiale. La plupart des CMH entrainent une obstruction dynamique à l’éjection du VG, soit au repos soit à l’effort. Illustration de BOUILLAUD montrant une cardiomyopathie hypertrophique symétrique [2]. |
 |
 |
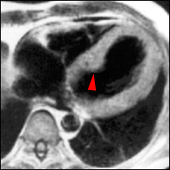
Cardiomyopathie hypertrophique de la partie basse du septum médian, atteignant 22 mm d’épaisseur maxi, n’entrainant pas d’obstruction à l’éjection VG, avec ondes Q pathologique et négativité des ondes T sur l’ECG et hypersignal pathologique post-gadolinium dans les portions renflées du septum (flèche rouge).
Hansen 2007(a) [3] a présenté une excellente revue sur la place de l’IRM dans l’étude des CMH. L’IRM trouve notamment une place complémentaire intéressante à coté de l’échographie pour préciser la distribution de l’hypertrophie, pour quantifier la masse VG (cf: suivi évolutif) et surtout pour révéler des possibles plages de rehaussement tardif qui traduisent des foyers de fibrose ou de nécrose tissulaire – ce qui ne peut être objectivé par aucune autre méthode diagnostique (O’Hanlon 2007 [4], Karamitsos 2007 [5], Lim 2007 [6]). Il est intéressant de noter qu’en raison de la distribution segmentaire de l’hypertrophie, la masse ventriculaire gauche mesurée par IRM (méthode 3D) n’est pas obligatoirement augmentée comme cela a pu être montré chez 20% des patients par l’équipe de Maron [7].
MULTIPLES VARIÉTÉS ANATOMIQUES
Les variétés anatomique sont dominées par les formes asymétriques septales et ont été répertoriées dans la classification échocardiographique de Maron qui distingue :
– type I : atteinte limitée à la partie antérieure du septum (10%)
– type II: hypertrophie touchant l’ensemble du septum (20%)
– type III: hypertrophie intéressant le septum et la paroi antéro-latérale (52%)
– type IV: où l’atteinte est localisé à d’autre région que le septum basal (18%), mais rarement en postéro-latéral (6%).
Une réévaluation par IRM effectuée chez 333 patients (Maron 2009 [8]) montre que l’atteinte la plus fréquente touche la paroi antéro-basale et la portion contigue haute du septum basal (77%), avec des lésions focales dans 12% des cas, intermédiaires dans 34% des cas et diffuses dans 54% des cas. Chez 13% des patients l’hypertrophie est bi ou multifocale. L’hypertrophie est plus importante en cas d’obstruction sous aortique (>30 mmHg). Les segments avec hypersignal post-gadolinium sont plus hypertrophiés que les segments sans hypersignal. Les territoires difficiles à analyser en échographie (paroi antérolatérale, septum postérieur et apex) concernent 12% des CMH.
Dans ce chapitre nous avons séparé les formes concentriques, les formes asymétriques (septales) et les formes apicales ; sachant que d’autre variantes sont possibles, notamment des formes localisées d’allure pseudo-tumorale et les aspects évolués tardifs avec déformations anévrysmales ou dilatés hypokinétiques (burned out phase).
L’IRM a montré que le VD est également impliqué dans les CMH (épaisseur pariétale et masse VD accrues, Maron 2007 [9])
Certains segments hypertrophiés peuvent être mal visibles en échographie et bien identifiés en IRM (3 patients sur 48, en antéro-latéral, pour l’équipe de Maron) ; raison pour laquelle la masse VG est plus élevée en IRM qu’en échographie dans ces situations (Rickers 2005 [10]).
PIEGES DIAGNOSTIQUES
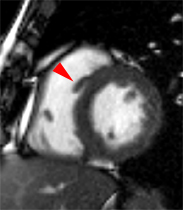 |
Implantation inhabituellement haute et postérieure de la bandelette ansiforme contre le bord droit du septum basal (flèche) chez un patient adressé en IRM pour suspicion de CMH septale suite à un examen échocardiographique.
CARDIOMYOPATHIE HYPERTROPHIQUE CONCENTRIQUE
| L’hypertrophie myocardique concentrique ou symétrique (ratio épaisseur septale/épaisseur de la paroi postérieure < 1.3) est une variété peu fréquente de CMH qui peut poser le problème du diagnostic différentiel avec les HVG secondaires du sportif ou des surcharges barométriques (HTA ou rétrécissement aortique).En principe le contexte clinique permet de faire le diagnostic.
Dans les cas douteux, la recherche de plages de rehaussement tardif post-gadolinium constitue un atout complémentaire important. |
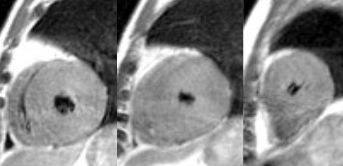 |
– Au contraire, l’absence d’hypersignal pathologique est en faveur d’une HVG du sportif.
– En cas de sténose aortique sévère, des hypersignaux (plutôt sous endocardiques) sont retrouvées chez 27% des patients lorsque l’épaisseur diastolique des parois dépasse 18 mm, [11]) mais l’examen doppler (ou l’étude de la valve aortique en ciné IRM) permet de discriminer sténose valvulaire et CMH.
– Dans l’HVG de l’hypertendu, en absence de lésion ischémique associée il n’y a pas de plage d’hypersignal post-gadolinium. En cas d’atteinte coronaire associée, les lésions fibreuses cicatricielles sont sous endocardiques systématisées (ou transmurales).
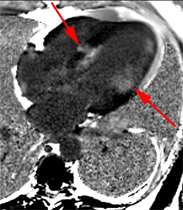 |
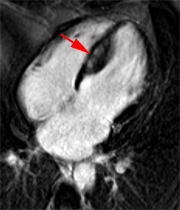
Découverte échographique récente d’une cardiopathie hypertrophique chez un patient de 49 ans non hypertendu. VG non dilaté à 85 ml/m2, mais parois épaissies (septum 22 mm), masse VG augmentée à 130 g/m2 (N<90). De multiples larges plages multiloculaires d’hypersignal post gadolinium sous endocardiques ou transmurale, sans systématisation coronaire sont observées au sein du myocarde hypertrophié.
REHAUSSEMENT DE SIGNAL POST GADOLINIUM
Signification du rehaussement tardif dans les CMH
Les plages de fibrose myocardique apparaissent en IRM sous forme de zones d’hypersignal sur les séquences pondérées T1 réalisées 10 mn après injection de gadolinium. Ces anomalies ne sont pas directement dictées par le génotype mais sont dépendantes du développement (progressif) de l’hypertrophie myocardique morphologique et électrique (phénotype). Ainsi par exemple, chez les patients présentant une mutation du gène TNNI3 de la troponine I, les plages de rehaussement tardif ne deviennent apparentes que lorsque l’HVG échographique est installée (Moon 2005 [12]). Les hypersignaux sont identifiés chez 80% des patients avec HVG échographique (extension 15% du myocarde en moyenne) vs 13% seulement (2 patients) si il n’y a pas d’HVG échographique nette.
Prévalence et siège des plages de rehaussement tardif
| Auteur [ref] | Prévalence (%) | Etendue (%) | La mise en évidence de plages d’hypersignal tardif dans les CMH constitue un apport essentiel de l’IRM dans l’exploration de ces affections.Le tableau ci-contre résume la prévalence de ces hypersignaux qui sont retrouvés dans une grande majorité de cas (de l’ordre de 7 à 8 fois sur 10), pouvant occuper jusqu’à 48% de la masse myocardique.
Ils prédominent dans les zones où l’hypertrophie est la plus importante et où les remaniement fibreux histologiques avec désorganisation myofibrillaire sont les plus marquées. |
|---|---|---|---|
| Bogaert 2003 [13] | 64 % (7/11) | nd | |
| Choudhury 2002 [14] | 81 % (17/21) | 8 ± 9% | |
| Moon 2003 [15] | 79 % (42/53) | 11% | |
| Motoyasu 2008 [16] | 77 % (13/17) | (selon FEVG & PFR) | |
| Kwon 2008 [[17] | 57 % (39/66) | (selon TV Holter) | |
| Debl 2006 [18] | 73 % (16/22) | 8.6 ± 7.4% |
Les lésions cicatricielles ne répondent pas à la distribution des atteintes ischémiques (sous endocardiques àavec systématisation coronaire) ou inflammatoires (sous épicardiques) mais sont nodulaires ou en mottes (patchy), volontiers multiloculaires médiopariétales. Elles prédominent à la jonction (haute ou basse) entre le septum et la paroi du VD dans les régions médianes ou basales. Ces plages de rehaussement tardif sont corrélées à l’épaisseur de la paroi et inversement corrélées à l’épaississement systolique (intérêt du tagging pour confirmer l’absence d’épaississement).
Valeur pronostique des plages de rehaussement tardif
Pour plusieurs auteurs, la présence et l’étendue des zones de rehaussement tardif constitue des marqueurs péjoratifs
– Etendue de 29% lorsque la maladie est évolutive vs 9% lorsque la CMH est stationnaire Moon 2003 [19] .
– Etendue de 16% lorsqu’il existe au moins 2 facteurs de risque de mort subite vs 7 à 9% dans le cas contraire (Moon 2003 et 2005).
– La rigidité artériel mesurée au niveau de l’aorte est accrue chez les patients avec CMH vs témoins ce qui constitue une condition défavorable pour la performance cardiaque (vitesse de l’onde de pouls 3.7±0.9 m/s chez les sujets sains vs 8.7± 5.8 m/s et même 9.7± 6.4 m/s en cas de fibrose myocardique) – Boonyasirinant [20].
– Le score de sévérité de l’hypersignal est inversement corrélé à la vitesse maximale de remplissage (PFR) qui caractérise la fonction diastolique (r=-0.86) ainsi qu’à la FEVG qui résume la fonction systolique (r=-0.59) – Motoyasu 2008 [21].
– L’étendue des plages d’hypersignal tardif (observées chez 57% de 66 patients avec CMH) est plus large (14% du myocarde) en cas d’épisodes de tachycardie ventriculaire au Holter qu’en l’absence de TV (6% du myocarde) : Kwon 2008 [22]. Pour Dimitrow 2008 [23] , des hypersignaux cicatriciels sont observés chez 97% des patients qui présentent des épisodes de TV non soutenue au Holter contre 60% seulement chez les patients sans TV au Holter. Suk 2008 rapporte des données similaires[24].
– La présence d’ondes Q sur l’ECG standard est également liée à la distribution des hypersignaux post-gadolinium. Ainsi, pour Papavassiliu 2007 [25], chez 12 (31%) des 38 patients avec CMH qui présentaient des ondes Q sur l’ECG, l’étendue segmentaire et transmurale des hypersignaux était plus marquée que chez les patients sans ondes Q, surtout si le ratio septum/ paroi postérieure dépasse 2. Pour Dumont 2006 [26] , la corrélation entre ondes Q et rehaussement tardif n’est observé que lorsque ces ondes Q sont larges (> 40 ms) ; le principal déterminant pour les ondes Q étant la sévérité de l’hypertrophie dans le territoire antéro-septal haut (plus de 20 mm env.).
STRATIFICATION DU RISQUE
La CMH expose au risque de mort subite par trouble du rythme ventriculaire ; en particulier lors de la pratique sportive. L’intérêt de l’IRM dans ce cadre a été passé en revue par Hansen 2007(b) [27]
Les critères de risque de mort subite justifiant l’indication d’implantation d’un défibrillateur implantable [28] sont :
En prévention secondaire : mort subite récupérée ou TV soutenue documentée.
En prévention primaire :
– Hérédité de mort subite chez un parent porteur d’une CMH.
– HVG extrême dépassant 30 mm.
– Salves de TV non soutenues au Holter.
– Antécédent de syncope, jugée sans caractère vagal.
– Chute tensionnelle à l’effort.
La sévérité de l’hypertrophie peut rendre compte des symptômes ou du gradient intraventriculaire mais ne dicte pas de manière claire le pronostic (Dubourg et al dans Echocardiographie clinique de l’adulte, Tome 1, p 606, 2003 Editions ESTEM [29]). Le lien entre le degré d’hypertrophie (type et sévérité) et les troubles du rythme ventriculaires est discuté.
La dilatation de l’oreillette gauche, fréquente dans cette affection, est également un indicateur important qu’il faut rechercher, en faveur d’une dysfonction diastolique consécutive à l’HVG. Elle constitue un indice de risque supplémentaire, favorisant le risque de fibrillation auriculaire et d’insuffisance cardiaque dans les formes avancées de la maladie. La dilatation de l’oreillette gauche (traduisant les conséquences des ) est un facteur pronostique négatif de la CMH [30].
Tardivement, l’évolution peut se faire vers l’hyposystolie avec réduction de l’épaisseur des parois, augmentation du diamètre VG et diminution de la FEVG (mais sans atteindre un aspect typique de CMD).
Enfin, comme il a été décrit ci-dessus, la présence et l’importance segmentaire et transmurale des plages de fibrose cicatricielle identifiées par l’IRM après injection de gadolinium constituent des indices pronostiques à prendre en compte dans la stratification du risque.