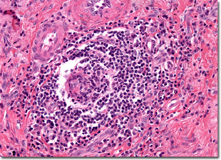
| Les granulomatoses idiopathiques sont caractérisées par des lésions histologiques avec réaction inflammatoire macrophagique non spécifiques faite d’histiocytes épithélioïdes associés à des cellules histiocytaires géantes multinucléées. Il s’agit principalement de la sarcoidose et de connectivites avec vascularite nécrosante des vaisseaux de petit calibre : maladie de Wegener et syndrome de Churg-Strauss et panartérite noueuse.Illustration d’un granulome sarcoidosique : follicule giganto-épithélioïde arrondi, bien limité, dépourvus de nécrose. Extrait de microscopyu.com : [1]
De multiples organes peuvent être touchés, dont le cœur. L’intérêt de l’IRM est de permettre une identification précoce des lésions, avant qu’elles ne soient détectables cliniquement ou par d’autres techniques. |
 |
SARCOIDOSE
La sarcoidose ou BBS (maladie de Besnier-Boeck-Schaumann) est une granulomatose d’étiologie inconnue pouvant toucher de multiples organes dont essentiellement le poumon, le médiastin, la peau, les synoviales, le cœur, le rein et le SNC.
L’atteinte est exclusivement pulmonaire dans environ 40% des cas, elle porte sur le poumon et d’autres organes dans 40% des cas est n’est extrapulmonaire que chez 20% des patients..
Le syndrome de Löfgren = érythème noueux, atteinte articulaire et adénopathies hilaires est une forme clinique de la période initiale de cette affection, indiquant alors repos, antalgiques et AINS. La corticothérapie n’est indiquée qu’en cas d’atteinte parenchymateuse pulmonaire ou viscérale, notamment cardiaque. Il n’y a pas de test diagnostic non invasif déterminant pour cette affection et le critère majeur du diagnostic repose sur la positivité d’une biopsie montrant la présence de granulomes épithélioïdes giganto-cellulaires, sans nécrose caséeuse (cf: Zuber Revmed.ch [2]).
L’atteinte cardiaque, observée dans 25% des cas à la nécropsie, ne se manifeste cliniquement que dans 5% des cas et serait de l’ordre de 10 à 20% des cas avec les techniques paracliniques habituelles. Il s’agit alors de douleurs thoracique, de défaillance cardiaque ou de TROUBLES ELECTRIQUES, conductionnels (bloc de branche et surtout BAV) ou d’hyperexcitabilité (ESV, TV), pouvant conduire au risque de MORT SUBITE (approximativement un tiers des cas). L’insuffisance cardiaque (> 1/3 des cas), peut être aigue (granulomes) ou chronique (fibrose cicatricielle avec possible anévrysme). L’atteinte péricardique (10-20 %) est généralement asymptomatique.
Des anomalies échographiques peuvent etre observées chez 30% des patients asymptomatiques avec épaississement des parois, dyskinésie (septale), dilatation VG, diminution de la FEVG. Des hypofixation scintigraphique au repos ou à l’effort sont observées chez 10 à 30% des patients.
L’IRM doit faire partie des nouveaux critères diagnostique de l’atteinte cardiaque dans cette maladie car elle est très sensible dans ce domaine et s’avère capable de révéler des atteintes cardiaques chez 30 à 40% de patients de plus que ne le révèlent les signes cliniques, ECG, echographique ou scintigraphiques habituels. L’extension de l’hypersignal post-gadolinium traduit la sévérité de l’atteinte cardiaque et comporte une valeur pronostique (Smedema Chest 2005 [3]).
Séméiologie IRM
Deux stades chronologiques ont été décrits :
1) à la phase inflammatoire aiguë on observe des plages en hypersignal T2 et en hypersignal T1 post-gadolinium avec possiblement épaississement pariétal (oedème). La distribution est non coronaire, plutôt médiopariétale (Vignaux 2005 [4]) et prédomine dans les régions basales septales ou latérales (Smedema JACC 2005 [5], (Marcu 2005 [6]). Au-delà des formes nodulaires, ‘patchy’, en mottes (essentiellement septales), une atteinte transmurale peut simuler un infarctus (Dorfman 2005 [7]) et une extension plus diffuses peut conduire à la défaillance cardiaque. Les zones d’hypersignal tardif correspondent en général aux territoires hypokinétiques et aux plages de defect de fixation du thallium-201 en scintigraphie (Tadamura 2005 [8])
2) Période cicatricielle post-inflammatoire, avec persistance de plages d’hypersignal intramyocardiques en imagerie T1 post-gadolinium, moins étendue qu’à la période initiale. Les zones d’hypersignal pathologique correspondent à des territoires inflammatoires ou à des lésions sequellaires. De rares formes pseudo-tumorales avec hypertrophie septale ont été décrites ( Slater 2003 [9]).
Comme pour l’infarctus aigu, ce sont donc les séquences T2 qui permettent de discriminer les lésions aigues car elles traduisent l’inflammation focale et sont donc en faveur de l’évolutivité de la maladie (Bogaert 2005[10])
L’évolution des lésions sous traitement a montré une possible régression (corrélée à l’amélioration clinique (Vignaux 2002 . [11]). Les lésions sequellaires persistantes tendent a régresser comme pour l’infarctus en raison d’un effet de rétraction fibreuse (shrinkage – cf: Stauder 2005 [12]).
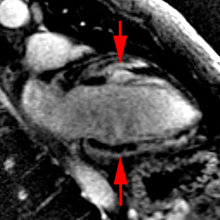
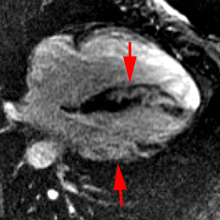
Chez cette patiente de 43 ans avec aspect de myocardite latéro-basale et qui avait présenté des douleurs thoraciques et un BAV 2:1, la présence de nodules de sarcoidose cutanée à la biopsie et d’adénopathies médiastinales au scanner à conduit à retenir le diagnostic de sarcoidose cardiaque. Le traitement a comporté : pacemaker + Bisoprolol, Prednisone 30 mg/j initialement et Methotrexate 2.5 mg/sem.
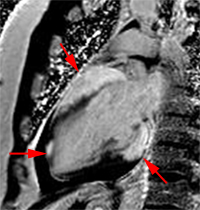 |
||
 |
||
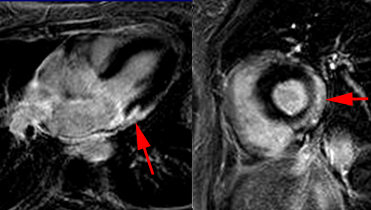
| ciné SSFP avant gadolinium | ciné SSFP après gadolinium | Séquence T1 après gadolinium |
Patient de 36 ans ayant présenté des douleurs thoraciques, un BAV du 3ème degré et des salves de TV. FEVG 40%, coronarographie normale, visualisation de foyers d’hyperactivité médiastinale en PET FDG correspondant à des adénopathies au scanner. Larges plages d’hypersignal intramyocardiques après gadolinium (flèches), dyskinésie VG et épanchement péricardique modéré. Instauration de Prednisone 1mg/kg, Bisoprolol, Ramipril et implantation d’un défibrillateur.