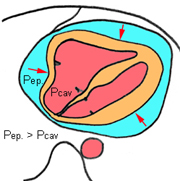
Les épanchements péricardiques hémorragiques peuvent s’observer après chirurgie cardiaque, suite à un traumatisme, comme complication d’un traitement anticoagulant ou en cas de tumeur maligne.
A la phase subaigue (dans les premiers jours et semaines), l’élément caractéristique évoquant une hémorragie est l’HETEROGENEITE du signal quelque soit la pondération utilisée (T1, T2, écho de gradient). Ceci s’explique par la présence simultanée de composantes hémorragiques d’âge variable avec du sang liquide et des portions thrombosées (caillots) plus ou moins anciennes contenant des produits de dégradation de l’hémoglobine aux propriétés paramagnétiques variables selon leur ancienneté.
Le tableau ci-dessous rappelle les caractéristiques principales du signal péricardique selon le type de pathologie
|
ES T1 |
ciné (GRE, SSFP) |
| Epanchement |
hyposignal |
hypersignal |
| Hémorragie |
hétérogène |
hétérogène |
| Epaississement |
hyposignal |
hyposignal |
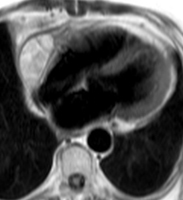
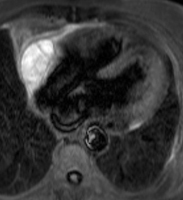
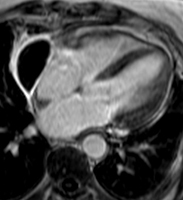
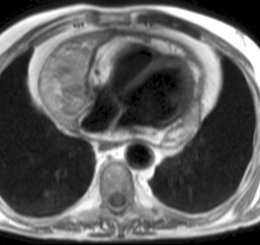
Les figures ci-dessous illustrent cette hétérogénité de signal en cas d’hémorragie chez un patient de 66 ans hospitalisé pour douleurs thoraciques et dyspnée, présentant un volumineux épanchement compressif dans un contexte de traitement anticoagulant avec INR excessif, sans notion de contusion thoracique, ayant nécessité une péricardocentèse en milieu chirurgical qui a permis de retirer 500 ml de liquide hémorragique sans cellule tumorale associée. Un épanchement relativement abondant persite toutefois mais sans prise de contraste anormale après injection de gadolinium, ce qui est en faveur d’un tarissement de l’hémorragie.
 |
 |
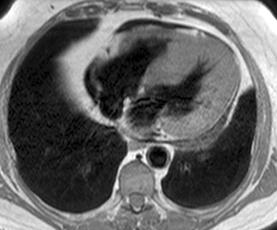
| Echo de spin pondéré T1 (TE 9 ms) : épanchement péricardique important très hétérogène prédominant contre les cavités droites |
Echo de spin pondéré T2 (TE 23 ms) : aspect également hétérogène du signal avec des zones d’hypersignal et des zones d’hyposignal correspondant à des foyers hémorragiques de date variable (portions liquidiennes avec présence de caillots |
 |
 |
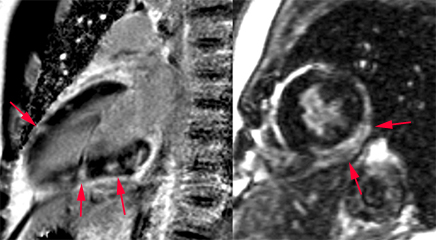
| Echo de gradient (SSFP) avant injection de gadolinium retrouvant un aspect hétérogène du signal comme en écho de spin |
Même séquence en écho de gradient réalisée 5 mn apres injection de gadolinium. Pas de prise de contraste significative ce qui est en faveur d’une hémorragie stabilisée, sans suffusion nette persistante. |
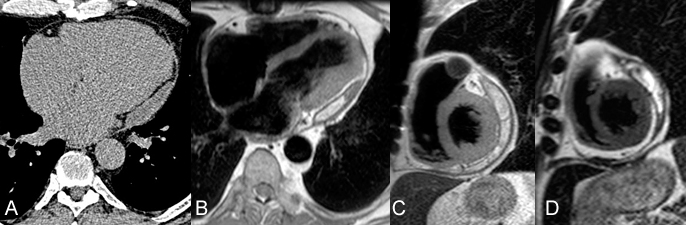
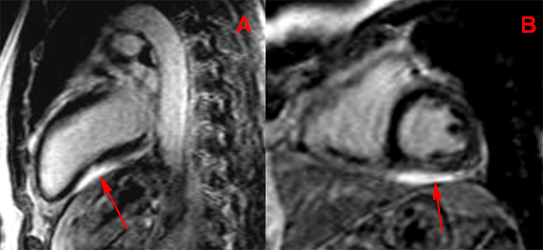
Epanchement péricardique postérieur peu important (15 mm maxi), localisé derrière la paroi postérieure du VG chez un patient de 64 ans opéré quelques semaines auparavant d’un remplacement valvulaire aortique pour IAo. sévère. Le scanner non injecté (A) ne montre que peu d’hétérogénité de densité dans cet épanchement mais l’IRM en écho de spin pondéré T1 (B et C) et pondérée T2 (D) révèle deux composantes distinctes avec une zone centrale en hypersignal correspondant vraisemblablement à un hématome dans ce contexte post-opératoire.
 |
Echo de spin T1. Exemple d’hémopéricarde chez une patiente présentant une polyarthrite rhumatoide, opérée pour remplacement valvulaire aortique quelques semaines auparavant. Noter l’hétérogénéité du signal intrapéricardique traduisant différentes étapes de dégradation de l’hémoglobine |
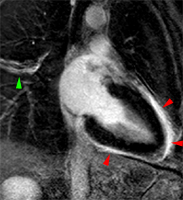
Volumineux épanchement péricardique atteignant 35 mm d’épaisseur, comprimant les cavités droites, chez un patient de 56 ans présentant une polyarthrite rhumatoïde sévère. L’aspect très hétérogène en écho de spin T1 (A) et en écho de gradient (B), avec serpentin d’hypersignal central, est en faveur d’un épanchement hémorragique organisé. Noter l’absence de rehaussement de signal précoce sur les séquences dynamiques au premier passage de gadolinium (C) et la présence d’un épanchement pleural bilatéral.
Classiquement, l’ancienneté de l’hémorragie peut s’apprécier selon le diagrame de ‘cycle lunaire’ identifiable lors des hémorragies cérébrales ou intraparenchymateuses (cf: comprendre l’IRM, manuel d’auto-apprentissage de B Kastler, Masson éditeur, 6eme édition, page 190 [1]).
 |
 |
 |
 |
Hématome suraigu
Sang liquide
Premières heures
T1 long, T2 long
Hypo-T1, hyper-T2 |
Hématome aigu
Caillot déoxyHb, métHb
Premiers jours
T2 et T2* plus courts
Iso-T1, hypo-T2 |
Hématome subaigu
Premières semaines
Lyse GB, libère Hb
T1 plus court, T2 court
Hyper-T1, hypo-T2 |
Hématome chronique
Mois suivants
Phagocytose périphérique
Hypo annulaire, hyper T2 central |
Cette séméiologie n’est toutefois pas bien transposable en cas d’épanchement péricardique hémorragique (car il n’y a pas le même environnement parenchymateux qui permet la transformation de l’hémoglobine par les macrophages).