Infarctus/Thrombus VG
 |
 |
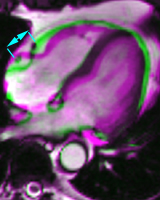
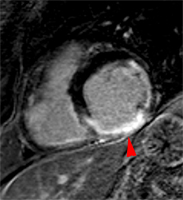
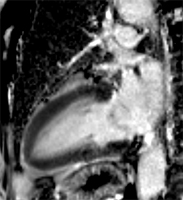
Petit thrombus apical post-infarctus comportant deux formations distinctes. L’hypersignal post-gadolinium est surtout sous endocardique dans les portions médianes et basales du septum et de la paroi antérieure, transmural au tiers distal du VG avec akinésie séquellaire (flèches).
 |
 |
Petit thrombus apical post-infarctus, méconnu en échographie, chez un patient de 64 ans, ayant présenté deux mois auparavant un infarctus (troponine 14, CPK 4420) sur occlusion de l’IVA post-diagonale, recanalisée avec stent. L’hypersignal post-gadolinium est transmural au tiers distal du VG avec akinésie séquellaire (flèches).
Intérêt du gadolinium pour mettre en évidence un thrombus
 |
 |
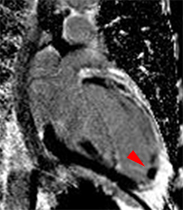
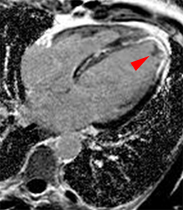
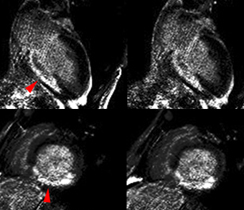
Bilan de lésions myocardiques chez un patient de 47 ans ayant présenté un infarctus antérieur 3 semaines auparavant. Les incidences grand axe montrent une akinésie antérieure nette mais seule les séquences ciné et de rehaussement tardif réalisées après injection de gadolinium (au milieu et à droite) mettent en évidence un thrombus sous endocardique apical centimétrique (qui n’était pas connu par ailleurs chez ce patient). Le gain en contraste explique l’essentiel du bénéfice obtenu avec le gadolinium ; le choix d’incidences plus adaptées à la lésion (mal identifiée avant gadolinium) est une autre explication pour l’amélioration du diagnostic.
Infarctus : aspect scintigraphique vs IRM
Dans le travail de Lund 2004 [1], mené chez 60 patients ayant présenté un infarctus aigu traité par PCI, il existe une bonne concordance globale entre l’estimation de la taille de l’infarctus (à J6±3), jugée par IRM (hypesignal tardif post-gadolinium correspondant en moyenne à 21±11% de la masse VG) et par scintigraphie (lacune de fixation du 201-Tl correspondant en moyenne à 19±14% de la masse VG). Le coefficient de corrélation linéaire r est de 0,73 et l’agrément entre les deux méthodes est de +1,3±9,8%. La principale discordance concerne l’absence de visualisation de 6 petits infarctus inférieurs en scintigraphie comparativement à l’IRM.
Tagging
 |
| Chapitre rédigé avec le concours du Dr Pierre Croisille, Laboratoire Creatis-LRMN, UMR CNRS 5220 & INSERM U630, Hôpital Cardiologique L.Pradel, Lyon |
Le tagging (ou tatouage) myocardique permet, comme le speckle tracking en échographie, de mesurer les déformations myocardiques dans toutes les directions. D’importants progrès dans les séquences d’imagerie et dans le post-traitement ont rendu cette technique accessible. Il en résulte une séméiologie nouvelle décrite dans ce chapitre. L’intérêt principal des multiples indices dérivés du tagging est d’apporter des nouveaux marqueurs de dysfonction contractile, plus précoces que les paramètres fonctionnels usuels, avant que les anomalies ne deviennent perceptibles visuellement.
Concept
Le concept de tagging (que l’on peut traduire par marquage ou tatouage) a été introduit en 1988 par Zerhouni [1] et Axel [2]. Il s’agit d’appliquer des lignes ou des grilles de saturation dans le plan de coupe au moment où survient l’onde R de l’ECG (fin de la diastole mécanique), afin de pouvoir suivre la déformation de ces lignes (d’hyposignal) en systole lors de la contraction cardiaque. La persistance des motifs de tagging durant les 20 à 40 images décrivant le cycle cardiaque (résolution temporelle de l’ordre de 30 ms) permet de quantifier les déplacement myocardiques liés à la contraction et à la relaxation.
 Une grille de lignes noires est appliquée sur l’image au moment du complexe QRS (image de gauche). Les images successives de la séquence ciné ensuite obtenues (toutes les 30 ms environ) montrent la déformation progressives de ces marques, en rapport avec la contraction cardiaque. En coupe petit axe on observe une incurvation centripète des lignes en systole (vers le centre de la cavité VG). En diastole, lors du retour à la position initiale on note une certaine atténuation du contraste par effacement des tags lié au T1 myocardique (fading).
Une grille de lignes noires est appliquée sur l’image au moment du complexe QRS (image de gauche). Les images successives de la séquence ciné ensuite obtenues (toutes les 30 ms environ) montrent la déformation progressives de ces marques, en rapport avec la contraction cardiaque. En coupe petit axe on observe une incurvation centripète des lignes en systole (vers le centre de la cavité VG). En diastole, lors du retour à la position initiale on note une certaine atténuation du contraste par effacement des tags lié au T1 myocardique (fading).
Plusieurs types de séquences peuvent être utilisées pour l’application des lignes de tag (SPAMM, Dante). Ces marques d’hyposignal s’estompent progressivement durant le cycle cardiaque (fading), en fonction du temps de relaxation T1 du myocarde. Le T1 du myocarde est de l’ordre de 600 à 700 ms à 1.5 T, il est plus long à haut champ (vers 1000 ms à 3T) de sorte que les images de tagging sont meilleures à 3T. Le T1 est plus court après injection de gadolinium, raison pour laquelle il vaut mieux éviter de faire des études de tagging après injection de gadolinium.
L’analyse visuelle est possible mais l’intérêt principal de la méthode consiste à extraire des paramètres quantitatifs à partir du déplacement des lignes durant le cycle cardiaque. Ce post-traitement peut être réalisé sur l’image elle-même en détectant et en suivant les lignes (tracking) ou par méthode de flux optique qui construit de vecteurs de déplacement. Actuellement, le post-traitement est surtout réalisé de manière automatique (non opérateur dépendante) dans le plan de Fourier avec la méthode HARP (Osman 1999 [3]). Les illustrations présentées ci-dessous ont été obtenues avec le logiciel InTag élaboré par les équipes universitaires de Maastricht et de Lyon (www.creatis.insa-lyon.fr/inTag/ [4]).
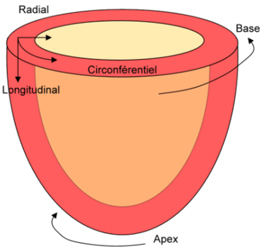
Trois composantes géométriques principales du strain (déformation)
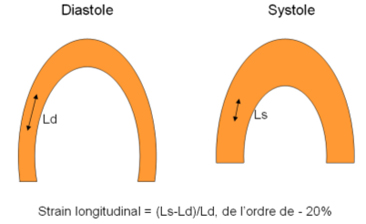
L’expression strain correspond à la déformation subie par une partie du myocarde lorsque sa forme change durant le cycle cardiaque. Le strain ou déformation segmentaire, est exprimé en pourcentage de changement de longueur deltaL d’un segment myocardique L dans une direction donnée : strain (%) = DeltaL/L. Le strain est positif en cas d’élongation et négatif en cas de raccourcissement.
Plutôt que d’utiliser les ‘vecteurs propres’ du champ de déformation, on préfère se référer aux trois composantes du strain, perpendiculaires (orthogonales) entre elles et correspondant à l’orientation du ventricule gauche (VG) : longitudinale, étudiée en coupe grand axe, radiale et circonférentielle étudiées en coupes petit axe.
1) Le strain longitudinal, négatif en systole, correspond au rapprochement base-apex.
2) Le strain radial, positif en systole, correspond au déplacement centripète vers le centre de la cavité. Il accompagne l’épaississement systolique pariétal.
3) Le strain circonférentiel, négatif en systole, est tangentiel aux parois dans le plan petit axe. Il traduit le raccourcissement circonférentiel.
Les ordres de grandeur de ces indices sont résumés dans le tableau II
 |
 |
| Les déformations circonférentielles et radiales sont obtenues à partir des coupes petit axe | La déformation longitudinale est obtenue à partir des coupes grand axe |
Mode de représentation des paramètres de strain
Ces différentes composantes du strain peuvent être représentées sous forme de courbes (évolution selon le temps dans le cycle cardiaque), de vecteurs superposés à l’image anatomique (champ de vecteurs) ou de cartes paramétriques couleur (pour chaque instant du cycle cardiaque), comme l’illustre l’exemple ci-dessous. Il est aussi possible de représenter le déplacement global (à ne pas confondre avec le strain ou déformation).
 Déformation circonférentielle correspondant au mouvement le long du périmètre (tangentiellement aux contours myocardiques) sur une coupe petit axe. L’image de gauche montre une image de tagging en systole. Au milieu est représentée l’image paramétrique du strain circonférentiel ; les teintes bleues correspondent aux déformations les plus importantes. A droite sont représentées les courbes de déformation sur six secteurs myocardiques. On constate que la déformation circonférentielle est plus intense (de l’ordre de -30%) dans les territoires antérieur et latéral. Les couches sous endocardiques présentent une déformation plus forte que les couches sous épicardiques.
Déformation circonférentielle correspondant au mouvement le long du périmètre (tangentiellement aux contours myocardiques) sur une coupe petit axe. L’image de gauche montre une image de tagging en systole. Au milieu est représentée l’image paramétrique du strain circonférentiel ; les teintes bleues correspondent aux déformations les plus importantes. A droite sont représentées les courbes de déformation sur six secteurs myocardiques. On constate que la déformation circonférentielle est plus intense (de l’ordre de -30%) dans les territoires antérieur et latéral. Les couches sous endocardiques présentent une déformation plus forte que les couches sous épicardiques.
L’expression la plus synthétique de ces multiples paramètre, tenant compte des normes régionales, est la représentation en z-score proposée par l’équipe de St Louis (Cupps 2010 [5]) qui consiste a représenter la surface 3D du VG avec une couleur qui exprime l’écart entre le strain composite observé et la norme établie en ce point chez des sujets témoins.
Le strain rate est la dérivée du strain (exprimé en 1/s) et correspond à la vitesse de déformation. Il est comparable à la vitesse d’éjection ou de remplissage décrit en ventriculographie isotopique (en ventriculographie isotopique, les vitesses maximales d’éjection ou de remplissage normales sont > 2.0 VTD/s).
| Champ des vecteurs de déplacementUne autre modalité de représentation du mouvement local consiste à dessiner les vecteurs de déplacement instantanés (à chaque instant du cycle cardiaque). |
Intérêt de confronter fluximétrie et volumétrie
Article en cours de construction
Infarctus : ECG vs IRM
L’IRM est devenu l’outil d’excellence et de référence pour faire l’inventaire des lésions ischémiques, surtout lorsqu’elles sont indétectables avec d’autres méthodes comme l’ECG. En cas de bloc de branche gauche notamment, l’IRM s’avère très utile pour s’assurer que les anomalies de contraction septales ne résultent que des troubles de conduction et non pas de cicatrices ischémiques surajoutées.
Classiquement, depuis Prinzmetal en 1954 [1], il est d’usage de considérer qu’un infarctus est transmural en présence d’ondes Q séquellaires et qu’il est sous endocardique en l’absence d’onde Q séquellaires. Cette distinction est à rapprocher de la classification en infarctus avec sus décalage du segment ST (qui donnera souvent des ondes Q) vs sans sus décalage ST (STEMI vs NSTEMI). Des études anatomo-pathologiques et plus récemment l’IRM ont montré que cette distinction est caricaturale, trop tranchée ; l’infarctus visualisé en IRM n’étant que faiblement corrélé à la présence d’onde Q (Wu 2001 [2]).
En étudiant par IRM et ECG 100 patients ayant présenté un infarctus, Moon (JACC 2004 [3]) a montré que le principal déterminant conduisant à la présence d’onde Q est la TAILLE de l’infarctus, plus que son extension transmurale. Si l’on considère la taille de l’infarctus pour prédire l’existence ou non d’onde Q, l’aire sous la courbe ROC est de 0.90 pour le territoire antérieur et de 0.77 pour le territoire inférieur. L’appréciation de l’atteinte latérale ne peut pas se faire à partir des ondes Q. Pour les atteintes antérieures, l’existence d’une lésion transmurale, qui est liée à la taille globale de l’infarctus, favorise certes l’apparition des ondes Q (70% des cas) mais une fraction non négligeable d’infarctus non transmuraux en IRM présentent également des ondes Q (28%). En considérant onde Q = transmural et sans onde Q = sous endocardique on se trompe une fois sur 3. Les auteurs insistent sur le fait que la classification transmural/non transmural est trop simpliste car pratiquement la moitié des infarctus sont transmuraux de manière segmentaire et car la quasi totalité des infarctus avec extension transmurale segmentaire présentent également des portions d’atteinte sous endocardique.
| La distinction infarctus avec onde Q ou sans onde Q – est utile cliniquement car elle discrimine les infarctus étendus, avec FEVG altérée. – mais n’est que très approximative ou identifier les lésions transmurales ou sous endocardiques. |
Dans une importante série de 1366 patients étudiés par ECG et IRM et suivis durant 31 mois, Krittayaphong 2009 [4] a montré que la sensibilité de l’ECG était très modeste – de l’ordre de 50% seulement – pour détecter un infarctus, tandis que la spécificité de l’ECG était assez bonne, de l’ordre de 92%. Les cicatrices identifiées par le rehaussement tardif en IRM constituent le meilleur prédicteur d’évènement cardiaque ultérieur, avant la FEVG et avant les signes ECG.
Une autre considération pratique – face à l’ECG d’un patient qui n’est pas connu – est d’étiqueter un aspect ECG d’ondes Q qui peut être trompeur ; les ondes Q n’étant pas synonymes d’infarctus. Il peut s’agir en effet de pseudo-ondes Q positionnelles, d’une CMH ou d’un syndrome de WPW.
| Ondes Q et lésion IRM transmuralePrésence d’ondes Q concordant avec des séquelles IRM transmurales. Ce cas le plus typique est illustré ci-dessous |
|
 |
 |
Exemple 2 :
 |
 |
 |
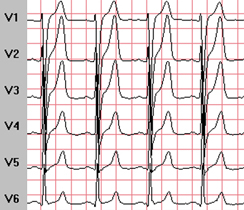
Grandes ondes Q en D2, D3 et aVf, concordant avec de larges séquelles d’infarctus inférieur transmural chez un patient de 45 ans polyvasculaire, grand fumeur, chez qui l’infarctus est survenu de manière asymptomatique.
| Ondes Q sans lésion en IRMLes ondes Q peuvent être trompeuses, de nature positionnelles, sans lésion identifiable en IRM : ni hypokinésie séquellaire ni hypersignal pathologique post-gadolinium. |
|
Le territoire inférieur est particulièrement intéressant dans ce contexte car la scintigraphie apporte des réponses parfois ambiguës à ce niveau ; compte tenu des problèmes d’atténuation diaphragmatique et de respiration pouvant entrainer des hypoactivités inférieures trompeuses.
 |
 |
 |
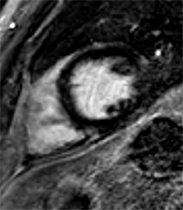 |
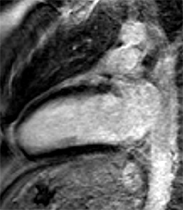
Patient de 32 ans, admis aux urgences en raison de douleurs thoraciques suspectes. L’ECG révèle la présence d’ondes Q fines mais assez profondes isolées en D3 , ne régressant pas lors de l’inspiration. Le coro-scanner montre une naissance anormale de la coronaire droite, provenant du sinus de Valsalva antéro-gauche avec un trajet initial en pince entre le tronc pulmonaire et la racine aortique. Malgré cette anomalie, il n’y a cependant ni hypokinésie inférieure ni hypersignal pathologique post-gadolinium en IRM. Les ondes Q en D3 sont donc positionnelles et non pas à caractère ischémique…
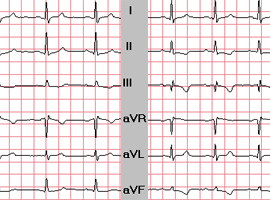
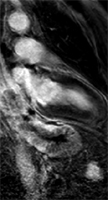
Exemple 2:
 |
 |
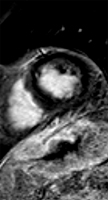 |
Patient de 62 ans asymptomatique sur le plan cardiaque, traité par radio-chimiothérapie exclusive pour une adénocarcinome mucipare du tiers inférieur de l’oesophage. Sur les ECG réalisés avant puis après traitement, on observe l’apparition de fines ondes Q en D3 et en aVF et d’ondes T négatives en inférieur. L’échocardiographie est peu contributive. L’IRM permet d’affirmer qu’il ne s’agit pas d’un infarctus inférieur (cinétique conservée et absence de rehaussement post-gadolinium).
| Absence d’ondes Q et lésion sous endocardiqueClassiquement on considère qu’un infarctus sans ondes Q est limité au sous endocarde. Ce tableau, illustré ci-dessous est fréquemment rencontré. |
|
Volumes et fonction VD
L’évaluation de la fonction systolique du VD n’est généralement pas aisée en échographie. A défaut de pouvoir obtenir une véritable fraction d’éjection du VD, une approche quantitative de la fonction contractile du VD consiste à calculer la variation de surface en coupe 4 cavités médio-ventriculaire (right ventricular fractional area change). La valeur normale de cet indice est de 40 à 74%. Cependant de larges portions du VD échappent ainsi à l’analyse (dont l’infundibulum qui compte pour 25% du volume).
L’IRM, au contraire, est un bon outil d’analyse du VD qui peut être découpé en tranches parallèles sans limitation du champ de vue, permettant ainsi de quantifier le volume 3D sans aucune supposition géométrique ou mathématique (méthode des disques de Simpson – comme pour l’étude du VG). Dans quelle incidence faut-il alors découper le VD ?
L’incidence petit axe, comme pour le VG, présente le grand avantage de permettre l’analyse simultanée des ventricules droit et gauche. Dans notre expérience, les difficultés d’entrée et de sortie de coupe au niveau de l’anneau tricuspidien rendent toutefois cette procédure incertaine, de sorte que nous préférons utiliser une pile de coupes axiales strictes, comme nous l’explicitons ci-dessous.
Difficultés importantes avec l’approche ‘petit axe’
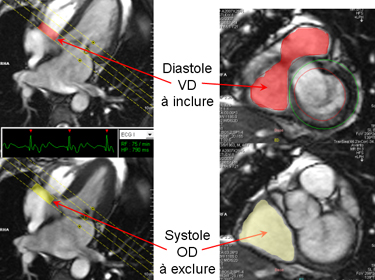
L’étude du VD en coupe petit axe pose des problèmes difficiles à la base du VD, au niveau du plan tricuspidien où il est très difficile d’affirmer si la coupe passe dans le VD ou dans l’OD. Il s’agit du même problème que pour la coupe basale du VG mais, contrairement au VG où il est assez facile de determiner l’épaisseur de la paroi myocardique, il n’est généralement pas possible de savoir avec certitude si la coupe passe devant ou derrière l’anneau tricuspidien comme l’illustre la figure ci-dessous.
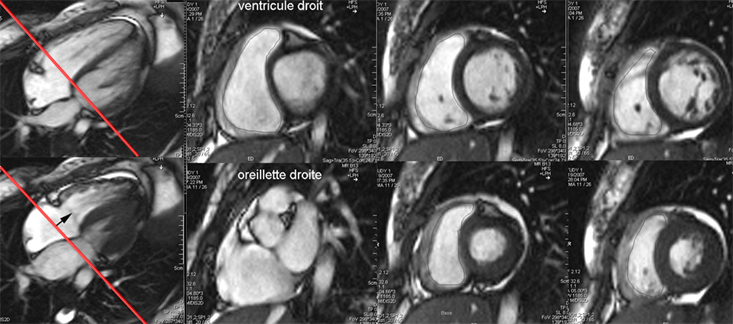 La ligne oblique rouge indique la position de la coupe basale petit axe en diastole (en haut) et en systole (en bas). En diastole la coupe passe dans le VD tandis qu’en systole la coupe est nettement localisée dans l’OD. Cette distinction n’est toutefois pas toujours évidente sur les images petit axe et il n’est pas commode de positionner pour chaque instant du cycle cardiaque l’image de référence ‘4 cavités’ correspondant au même instant du cycle afin de savoir où passe exactement la coupe.
La ligne oblique rouge indique la position de la coupe basale petit axe en diastole (en haut) et en systole (en bas). En diastole la coupe passe dans le VD tandis qu’en systole la coupe est nettement localisée dans l’OD. Cette distinction n’est toutefois pas toujours évidente sur les images petit axe et il n’est pas commode de positionner pour chaque instant du cycle cardiaque l’image de référence ‘4 cavités’ correspondant au même instant du cycle afin de savoir où passe exactement la coupe.
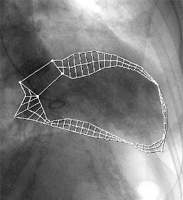
Exemple de contourage du VD et du VG à partir d’une pile de 8 coupes petit axe :
| Volumes (ml) :Ventricule droit : VTD = 140 ml VES = 80 ml Ventricule gauche : Flux Aortique = 77 ml Ces écarts traduisent l’ordre de grandeur de l’imprécision des mesures (env. 20%) |
Approche avec une pile de coupes axiales
Le recours aux coupes axiales permet de contourner cette difficulté et offre une excellente identification du plan tricuspidien dont les contours sont ainsi facile à dessiner, en diastole comme en systole. Malheureusement une autre difficulté apparait avec cette méthode : l’effet de volume partiel qui affecte les coupes extrêmes en haut et en bas.
A la partie supérieure, il s’agit de la valve pulmonaire dont l’identification est généralement possible ; en toute hypothèse des erreurs de planimétrie à la jonction avec le tronc de l’artère pulmonaire ne sont pas critiques car elles ne contribuent que de façon marginale à la volumétrie du VD.
A la partie basse, par contre le problème peut être plus difficile car il concerne le plancher du ventricule droit qui entre et qui sort du plan de coupe durant le cycle cardiaque comme le montre la figure ci-dessous. Or l’intensité du signal sanguin dans cette portion du VD est atténuée en raison du ‘mélange’ qui existe avec la paroi inférieure (définition de l’effet de volume partiel). Les contours de cette portion du VD peuvent donc être difficile à ce niveau, ce qui est important car cette contribution segmentaire est significative dans le volume total du VD.
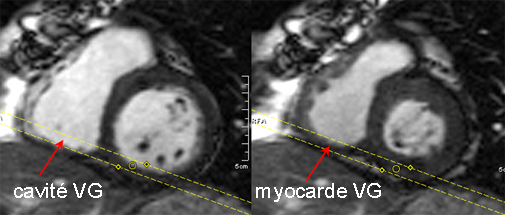 |
En diastole la coupe basse (lignes pointillées) est dans la cavité VG, en systole, la coupe est en volume partiel avec la paroi myocardique et le contourage de la cavité VD est difficile à réaliser. Le plan tricuspidien reste cependant bien défini à tous les instants du cycle cardiaque
Exemple de volumétrie du VD chez un patient avec infarctus du VD
 |
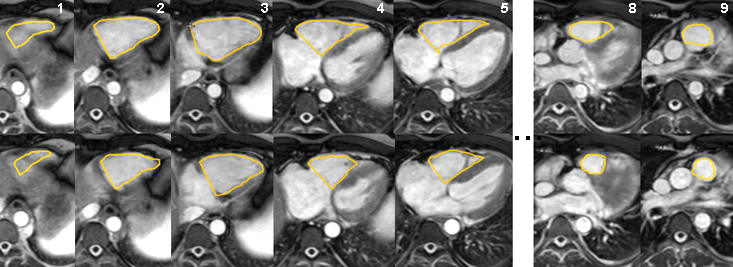
Les contours endocardiques du VD sont tracés manuellement sur ces coupes en diastole (ligne du haut) et en systole (ligne du bas).Neuf niveaux de coupe de 10 mm d’épaisseur ont été nécessaires pour couvrir les ventricules droit et gauche.
Seule la coupe la plus basse (N°1, à gauche sur la figure) pose des difficultés de contourage en raison de l’effet de volume partiel au niveau du plancher ventriculaire. Les ciné et l’imagerie de rehaussement tardif de ce patient sont présentés dans la section sur l’infarctus du VD. |
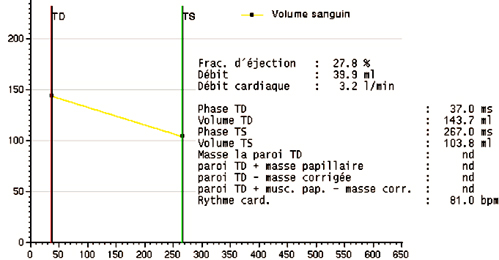
Patient de 37 ans avec infarctus inférieur étendu au VD. Les volumes mesurés ici sur la pile de coupe axiales couvrant les ventricules droit et gauche indiquent :
Ventricule droit : VTD=144 ml, VTS=104 ml, VES=40 ml, FEVD=28%.
Ventricule gauche : VTD=105 ml, VTS= 56 ml, VES=49 ml, FEVG=47%.
Une discordance de moins de 20% entre les volumes d’éjection systolique droit et gauche se situe dans la gamme acceptable d’imprécision de la mesure.
Normes de volume pour le ventricule droit
Les valeurs normales de volumes et de masse du ventricule droit dépendent des méthodes de mesures (comme pour le ventricule gauche). Nous rapportons ici les résultats obtenus par l’équipe d’Alfakih (Magn. Reson. Imaging 2003;17:323–329), en ciné SSFP à partir d’une pile de coupes petit axe avec exclusion des piliers (non comptés dans la masse myocardique).
| IVTD (H) | IVTD (F) | IMVG (H) | IMVG (F) | FE (H) | FE (F) | |
|---|---|---|---|---|---|---|
| VG | 82±15 | 78±11 | 65±9 | 52±7 | 64±5 | 64±5 |
| VD | 86±14 | 75±14 | env. 25 | env. 23 | 55±4 | 60±5 |
Comme nous avions pu le constater dans le tableau consacré aux normes du VG, les valeurs de volume ventriculaire rapportées par Alfakih en technique SSFP sont supérieures aux normes de la plupart des auteurs et les valeurs de masse VG sont plus faible. Les normes concernant les enfants (8 à 17 ans) ont été publiées par Robbers-Visser 2009 [1].
On retiendra en pratique :
| * L’IRM est un excellent outil, singulier, d’étude et de quantification du VD. |
| * Volumes et masse ventriculaires sont plus élevés chez l’homme que chez la femme. |
| * Les volumes ventriculaires droits sont un peu plus élevés qu’à gauche. |
| * La fraction d’éjection du VD est plus faible que celle du VG. |
| * La masse VD est 2 à 3 x plus petite que la masse ventriculaire gauche. |
Concept d’infarctus myocardique « avorté »
| Débat actuel sur l’étiologie de la sidération myocardique : Tako-Tsubo ou infarctus avorté ? |
| La sidération myocardique (stunned myocardium) est définie comme une dysfonction contractile spontanément régressive |
| Douleurs thoraciques suspectes d’infarctus, troubles de repolarisation sur l’ECG, absence d’élévation enzymatique significative, dysfonction contractile segmentaire spontanément réversible du VG et coronarographie normale sont les signes communs au Tako-Tsubo et à l’infarctus myocardique « avorté ». |
| Un nombre croissant d’auteurs (ex: Ibanez 2006 [1], Khallafi 2008 [2]), pensent que le syndrome du Tako-Tsubo n’est rien d’autre qu’une forme clinique d’infarctus « avorté » dont l’indice saillant est l’anamnèse, dominée par la survenue consécutive à un choc émotionnel intense. |
| Selon le concept de « stunned myocardium », qui exclu par définition la nécrose tissulaire constituée, les anomalies contractiles résultent de l’interruption d’irrigation sanguine durant quelques minutes, avec restauration retardée de la fonction dans des délais beaucoup plus long (de quelques heures à quelques jours). Par opposition, dans le syndrome du Tako-Tsubo il n’y aurait PAS d’obstruction vasculaire transitoire et la sidération myocardique serait la conséquence d’une décharge cathécholergique massive (cardiomyopathie transitoire de stress). |
| La question n’étant pas tranchée, nous avons laissé ces deux entités sur des pages distinctes du site, quoiqu’il n’y ait pas de différence séméiologique notable entre elles sur le plan IRM… |
| (Tako-Tsubo) |
Le concept d’infarctus « avorté », initialement évoqué par Weaver – rapportant l’essai clinique MITI en 1993 – est passé en revue par Verheugt 2006 [3]. Il se définit dans le cadre d’un syndrome coronaire aigu par un sus décalage du segment ST régressant d’au moins 50% avec absence d’élévation enzymatique au-delà de 2 fois la limite supérieure de la normale. Sa prévalence serait de 13 à 17% chez les patients traités par fibrinolyse et atteindrait 25% chez les patients traités durant la première heure.
Une thrombose coronaire suivie de reperfusion spontanée (cf: balance physiologique entre thrombose coronaire et fibrinolyse endogène) ou thérapeutique dans des délais suffisament brefs pour éviter la nécrose tissulaire constitue la physiopathologie de ce syndrome. Des vagues d’occlusions / reperfusions successives sont possibles. Les délais de restauration fonctionnelle sont beaucoup plus longs que les durées d’occlusion coronaire et les temps de récupération s’ccroissent de manière non linéaire avec les durées d’anoxie (par exemple, récupération contractile en 15 mn si l’occlusion dure 3 mn et 48 h si l’occlusion dure 30 mn). Un panachage entre sidération et nécrose myocardique est possible si l’anoxie se prolonge (cf: continuum avec l’état d’infarctus constitué ‘classique’, d’abord sous endocardique puis transmural…).
Stunned myocardium : Tako-Tsubo ou Infarctus « avorté » ?
 |
 |
||
 |
 |
 |
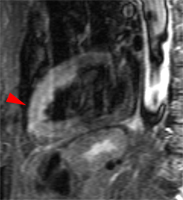
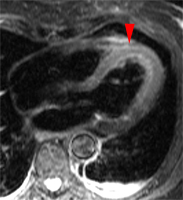
Akinésie antérieure du VG chez une patiente de 74 ans admis 2 jours avant l’examen IRM pour douleurs thoraciques avec aspect ECG d’ischémie sous épicardique antérieure étendue. Troponine limite à 0,22. Coronarographie normale. Normalisation de la cinétique VG secondairement en échographie, avec FEVG 70%.
Une akinésie antérieure est bien visible sur les séquences ciné. Aucune lésion myocardique n’est toutefois visible sur les séquences T1-PSIR réalisées après injection de gadolinium (images de droite) alors qu’un hypersignal de la paroi antérieure est bien identifié sur les images STIR-T2 (à gauche – flèches), signant la présence d’un oedeme tissulaire sans nécrose.
Ce tableau évoque un phénomène de ‘stuned myocardium’, spontanément régressif, soit par syndrome de Tako-Tsubo (mais absence de contexte de grand stress chez ce patient), soit par ‘infarctus avorté’ dument documenté comme décrit dans l’article de Tarantini 2005 [4] .
Infarctus à coronaires saines
La détection de lésions myocardiques dans les suites d’un tableau de syndrome coronaire aigu avec élévation enzymatique significative et coronarographie ‘normale’ constitue assurément une des indications les plus intéressante de l’IRM cardiaque qui permet ainsi souvent de trancher entre élévation de troponine significative (hypersignal pathologique) ou non [1]
Il s’agit ici de lésions tissulaires de taille modérée voire petite, volontiers sous endocardique, n’ayant pas entrainé de séquelles contractiles qui auraient permis l’identification de l’infarctus en échographie ; d’autant plus que la scintigraphie est volontiers mise en défaut dans ces atteintes punctiformes ou limitées au sous endocarde. Dans ce cadre, l’IRM est également très utile pour faire le diagnostic différentiel avec une myocardite (lésion sous épicardique).
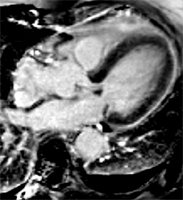
Territoire IVA
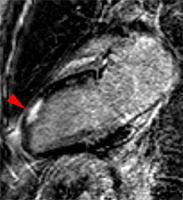 |
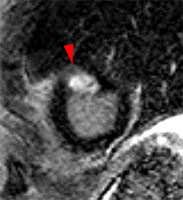 |
Petit infarctus antérieur médian transmural chez une jeune patiente de 30 ans, adressée en IRM pour suspicion de myocardiqte dans un contexte de douleurs thoraciques suspectes avec élévation de enzymatique modérée et coronarographie normale.
Artère Marginale
Artère circonflexe ou marginale
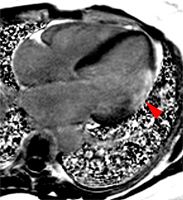 |
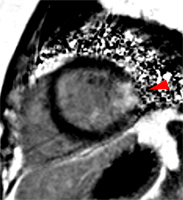 |
Cet examen a été demandé chez une patiente de 39 ans, hypertendue, tabagique, admise à deux reprises en 5 semaines, en raison de manifestations de syndrome coronaire aigu. Une élévation de troponine sans sus décalage du segment ST était observé lors du 1er épisode. Les deux coronarographies réalisées sont restée négatives (athérome IVA1 sans sténose). L’IRM montre une assez large lésion transmurale latérale médiane avec une hypokinésie modérée qui n’était pas remarquée en échographie (l’analyse de la paroi latérale est souvent difficile ou limitée en échographie).
Artère coronaire droite
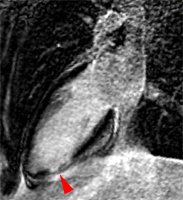 |
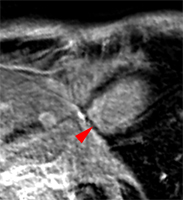 |
Infarctus inférieur distal transmural de 20 mm de diamètre environ chez une jeune patiente de 22 ans avec élévation de troponine à 9.2 et coronarographie normale (coronaire droite recanalisée). Contexte tabac + pilule ?
 |
Petite lésion ischémique nodulaire inféro-septale basale chez un patient tabagique de 47 ans avec douleurs typiques élévation enzymatique signiicative et coronarographie normale |
Evaluation coeur droit
L’anatomie du VD est décrite dans la section coeur normal. La volumétrie du VD et le calcul de la fraction d’éjection sont détaillées dans la section suivante.
Indices fonctionnels usuels (échocardiographie doppler)
L’indice TAPSE (tricuspid annular plane systolic excursion), qui quantifie l’excursion de l’anneau tricuspidien, est un marqueur simple et intéressant de l’état fonctionnel du VD.
L’indice de TEI (durée des périodes de relaxation + contraction isovolumique)/durée de l’ejection ventriculaire – N< 30-40% est également un indicateur fonctionnel interessant en écho-doppler (à partir des courbes de flux mitral et de flux aortique) mais n’est pas bien abordable en IRM. La mesure du dP/dt sur la courbe du flux de régurgitation tricuspidienne (N>1500-2000 mmHg/s) est un indice de contractilité intrinsèque qui n’est pas non plus accessible en IRM.
Les nouvelles méthodes écho-doppler, basées sur le ‘speckle tracking’ apportent des indices fonctionnels supplémentaires, en particulier pour l’étude du synchronisme VD (strain: déformations radiales ou longitudinales). En IRM, le tagging ou la cartographie des vitesses appliquée au myocarde pourraient, en principe, fournir des indices comparables mais la mise en oeuvre et le post-traitement de ces méthodes reste du domaine de la recherche.
Principaux états pathologiques du VD
Sur le plan morphologique, on distingue :
– les surcharges VD barométriques, en pression, qui entrainent une hypertrophie des parois myocardiques et résultent d’un obstacle sur la voie d’éjection droite (sténose pulmonaire, HTAP, embolie pulmonaire, BPCO).
– les surcharges volumétriques, dominées par une distension de la cavité VD. Ces dernières résultent essentiellement de cardiopathies congénitales : insuffisance pulmonaire, shunt de CIA, retour veineux pulmonaire anormal et suites de chirurgie réparatrice de tétralogie de Fallot.
L’augmentation de pression dans le VD va entrainer une inversion de la courbure septale : le VD prend la forme d’un VG et le VG prend alors une forme en croissant. Ces changements s’accentuent à mesure que l’on passe du coeur pulmonaire aigu (la dilatation transitoire du VD est le premier signe de l’embolie pulmonaire aigue) à l’HTAP constituée (coeur pulmonaire chronique post-embolique notamment). Dans un premier temps la cavité VD se dilate, le septum bombe vers le VG. Puis une HVD peut apparaitre, le VD devient sphérique et l’OD se dilate.
Enfin, il faut également évoquer l’infarctus du ventricule droit, la dysplasie du VD et le retentissement des déformations thoraciques comme le pectus excavatum.
Exemples d’HVD, combinant une hypertrophie myocardique avec une dilatation cavitaire chez un patient avec sténose pulmonaire (à gauche) et en cas d’HTAP primitive (3 cinés de droite). Noter le mouvement septal paradoxal prononcé en cas d’HTAP primitive et la distension majeure du tronc pulmonaire avec volutes de stagnation du flux sanguin.
L’étude de la compliance de la veine cave inférieure est ici capitale pour estimer les pressions de remplissage droites (cf: voir section sur la physiopathologie des atteintes péricardiques) et l’IRM en séquence temps réel est tout à fait capable de répondre à cette question comme cela est illustré par des exemples normaux et pathologiques.
L’atteinte du coeur droit peut également etre consécutive à une cardiopathie gauche (précoce en cas de cardiomyopathie dilatée hypokinétique, plus tardive en cas de cardiopathie ischémique), ou s’inscrire dans le cadre de maladies particulières. Citons par exemple le carcinoide du grèle (fibrose endomyocardique prenant surtout la tricuspide qui devient épaisse, rétractée, figée) ou la maladie des anticorps antiphospholipides pouvant donner un tableau similaire. D’autres formes de fibroses endomyocardiques peuvent également toucher le coeur droit (source de thrombi et de risque embolique). L’amylose cardiaque peut également intéresser le coeur droit et le septum inter-auriculaire.