Le concept de no-reflow
A l’heure actuelle, dans une majorité de cas, grâce à l’angioplastie coronaire, l’artère responsable d’un infarctus aigu peut-être désobstruée et le rétablissement circulatoire est habituellement jugé satisfaisant (grade de perfusion TIMI 3). Cependant, l’estimation de la macrocirculation au niveau des grosses artères épicardiques ne préjuge pas de l’irrigation tissulaire des territoires revascularisés comme le montre le phénomène de no-reflow. Le délai et la qualité de la recanalisation coronaire dans l’infarctus aigu ne résument donc pas le pronostic qui est également conditionné par le phénomène de no-reflow.
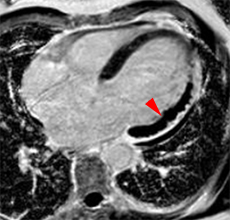
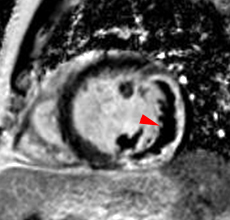
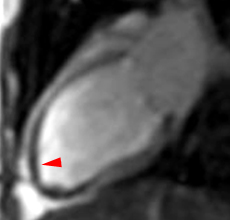
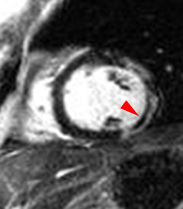
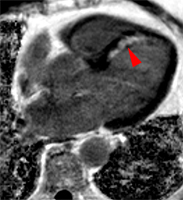
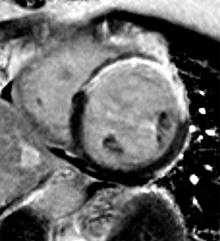
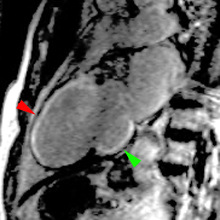
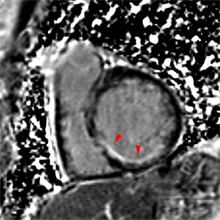
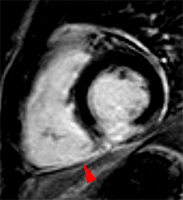
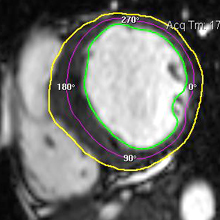
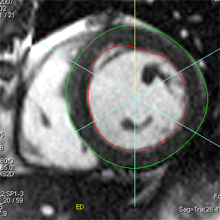
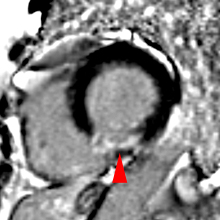
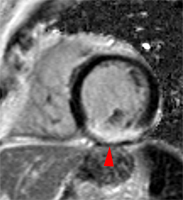
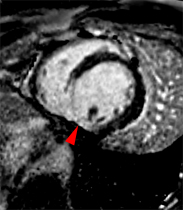
| Le concept de no-reflow a été décrit par Kloner en 1974, chez le chien, après occlusion coronaire temporaire [1]. Il s’agit d’un retard de perfusion tissulaire en rapport avec une obstruction micro-vasculaire à l’étage tissulaire d’aval. Ce phénomène est délétère car il s’associe à plus de complications évolutives (2).L’imagerie de perfusion (échographie ou IRM comme sur l’exemple ci-contre) permet de mettre en évidence le retard d’irrigation tissulaire en cas de no-reflow. Il s’agit d’un defect segmentaire de visualisation du produit de contraste injecté, prédominant au sous endocarde, plus ou moins fugace (quelques secondes à quelques minutes) après l’injection. |
 |
Il n’est pas nécessaire d’être en mauvais grade TIMI (<3) pour observer un phénomène de no-reflow, car même en cas de grade TIMI 3, des anomalies du profil d’écoulement (guide doppler intra-coronaire) ont été décrites. Les premières démonstrations de ce phénomène chez l’homme ont été faites par le groupe japonais de Ito en 92, grâce à l’échographie de contraste, en injectant des micro bulles par voie intra coronaire, immédiatement après recanalisation dans l’infarctus aigu [2]. Depuis, de multiples travaux échographique et d’IRM ont retrouvé ces anomalies avec des prévalences variables.
Grâce à l’imagerie dynamique, suite à une injection veineuse périphérique de gadolinium, l’IRM permet de bien étudier ce phénomène.
Physiopathologie : 3 strates d’atteinte tissulaire en cas d’obstruction coronaire
De multiples travaux réalisés depuis 1995 par le groupe du John Hopkins Hospital à Baltimore, en IRM de perfusion, par radio-traceurs et en histochimie ont révélé 3 aspects distincts de perfusion correspondant à 3 strates de tissus en cas d’occlusion artérielle (Wu 1998 [3]).
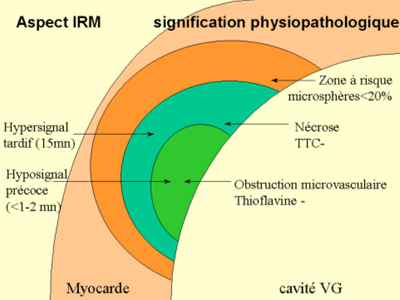 |
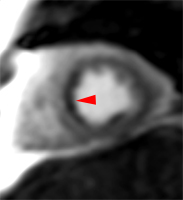
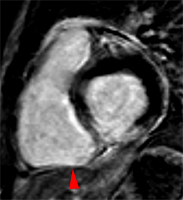
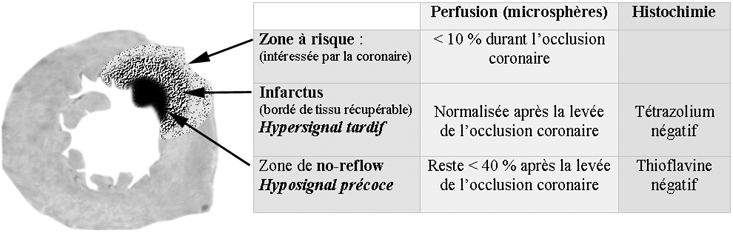
La figure ci-contre illustre ces 3 catégories de tissus, identifiables par des colorants histochimiques et dont les comportement sont spécifiques en IRM dynamique.1) Zone à risque, dont l’irrigation s’interrompt après l’occlusion d’une artère donnée. L’occlusion coronaire y entraîne une diminution du débit de plus de 80% lors des mesures par micro sphères marquées. Une grande partie de cette zone à risque reste viable, récupérable.
2) Territoire nécrosé, non récupérable, défini histochimiquement par la non coloration par le Tétrazolium (TTC-). Cette zonne apparaitra en hypersignal tardif post-gadolinium.
3) Territoire de no-reflow correspondant à l’obstruction microvasculaire, situé dans la région sous endocardique centrale de la zone infarcie (infarct core), non coloré par la Thioflavine. Cette zone correspond au no-reflow observé en imagerie de perfusion. |
Le mécanisme invoqué pour le no-reflow (10 à 30% du territoire de l’infarctus) procède de l’accumulation de bouchons microvasculaires constitués par des amas de neutrophiles et de micro thromboses au sein des capillaires dans la zone centrale de l’infarctus (infarct core). Cette boue microvasculaire avec stase érythrocytaire, associée à de larges destructions capillaires, entraîne une sévère réduction de l’irrigation. Le gonflement des cellules endothéliales et l’œdème extravasculaire accentuent ce phénomène.
Aspect IRM du no-reflow et du rehaussement tardif
L’IRM est bien adaptée à l’étude du no-reflow, phénomène dynamique, transitoire, car il est possible d’acquérir plusieurs images à chaque battement cardiaque selon n’importe quelle incidence de coupe. Les séquences dynamiques pondérées en T1 permettent ainsi de suivre la distribution tissulaire d’un agent de contraste (chélate de gadolinium) injecté par voie veineuse.
Chacun de ces tissus présente une cinétique d’évolution du signal caractéristique, comme l’illustrent les figures ci-dessous.
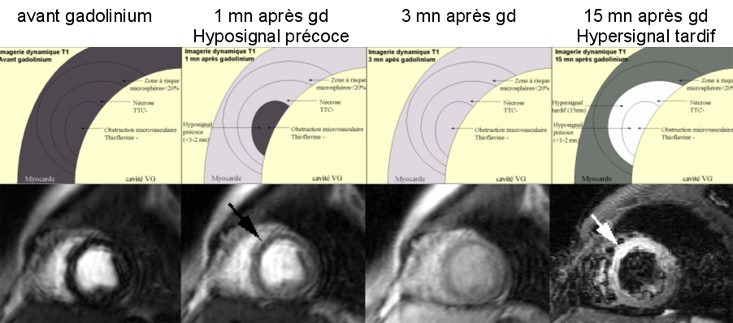
Au sein du myocarde normal, l’accroissement du signal est rapide (1-2 mn), puis s’amorce un plateau légèrement descendant qui correspond à l’épuration rénale du gadolinium (demi-vie similaire à celle des produits de contraste iodés). La zone centrale de no-reflow présente un accroissement initial lent (hyposignal précoce) qui atteint le niveau des autres zones en 2-3 mn mais parfois beaucoup plus tardivement (hyposignal persistant), puis l’évolution est superposable à celle de la couronne de nécrose qui l’entoure. La zone de nécrose reperfusée et épargnée par l’obstruction microvasculaire (en couronne), présente un accroissement initial rapide, quasi normal durant les 2 premières minutes. Ensuite, le signal ne diminue pas comme dans les zones saines mais reste élevé car le wash-out y est ralenti et car le volume de distribution y est augmenté. Cette rétention du gadolinium entraînera un hypersignal tardif dans les 10-15 mn qui suivent l’injection.
No-reflow ‘précoce’ au premier passage et ‘persistant’ dans les minutes qui suivent
No-reflow ‘précoce’ au premier passage :
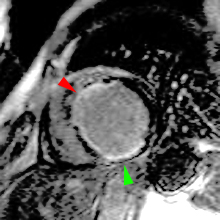
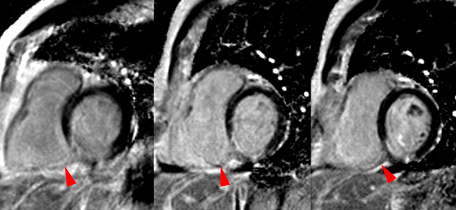
L’IRM dynamique au premier passage de gadolinium (une ou plusieurs images acquises lors de chaque battement cardiaque) est une méthode aisée et efficace pour voir le no-reflow, même en situation clinique (cf: illustration ci-dessous). Une faible dose de produit de contraste est suffisante (5 à 10ml injectés en quelques secondes). L’examen est rapide (2 mn), sans nécessité d’épreuve pharmacodynamique. La séméiologie d’hyposignal précoce, prédominant au sous endocarde du territoire nécrosé, est bien plus aisée à observer que l’hyposignal très fugace et souvent difficile à montrer lorsqu’il s’agit d’objectiver les conséquences ischémiques des sténoses coronaires. L’aspect de no-reflow reste visible durant une quinzaine de jours après l’infarctus aigu.
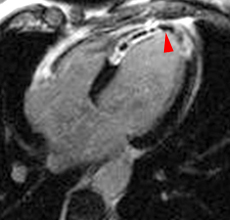
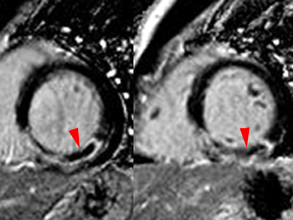
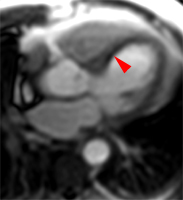
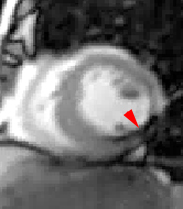
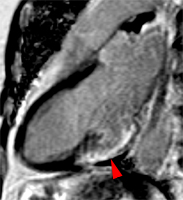
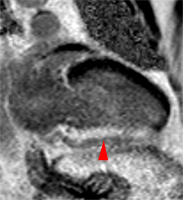
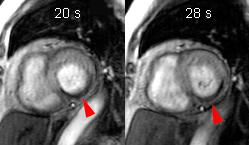
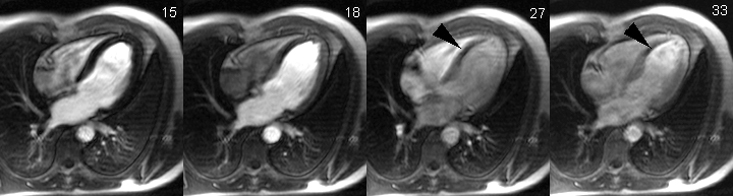 Illustration du phénomène de no-reflow au niveau septal, en coupes 4 cavités, lors du premier passage de gadolinium. Un défaut de rehaussement du signal septal correspondant au territoire de no-reflow (flèches) est visible sur le séquence d’images correspondant au premier passage de gadolinium (le délai en secondes par rapport à l’injection est indiqué sur chaque image).
Illustration du phénomène de no-reflow au niveau septal, en coupes 4 cavités, lors du premier passage de gadolinium. Un défaut de rehaussement du signal septal correspondant au territoire de no-reflow (flèches) est visible sur le séquence d’images correspondant au premier passage de gadolinium (le délai en secondes par rapport à l’injection est indiqué sur chaque image).
Lorsqu’il existe, le no reflow est toujours identifiable au premier passage de gadolinium. Si l’obstruction micro-circulatoire est plus marquée, le defect de signal peut-être plus prolongé ; les anomalies de signal persistant alors une ou plusieurs minutes après l’injection de gadolinium.
No-reflow persistant (5-10mn après injection) :
La persistance d’un aspect de no-reflow durant plusieurs minutes s’observe (de manière moins étendue) chez 74% des patients ayant un no-reflow au premier passage et correspond à des lésions plus sévères (Lund 2004 [4]). Nijveldt 2009 [5] observe (4 à 7 jours après infarctus recanalisé avec stent), une prévalence du no-reflow de 70% une minute après injection, de 62% 2 mn après injection et de 59% à la 13ème minute ; ce no-reflow tardif étant le meilleur prédicteur du remodelage VG ultérieur (dilatation des volumes VG et diminution de FEVG à 4 mois).
Cette situation de relative stabilité durant plusieurs minutes autorise l’utilisation de séquences offrant de bien meilleures performances que l’imagerie dynamique au premier passage. On utilise alors les mêmes séquences que pour le rehaussement tardif. Ces séquences en apnée, obtenues sur une douzaine de battements cardiaques (et non pas en ‘single shot’, en une fraction de battement cardiaque), offrent une meilleure résolution spatiale et un meilleur rapport signal/bruit.
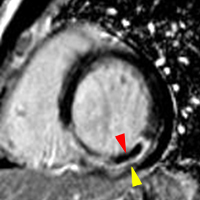 |
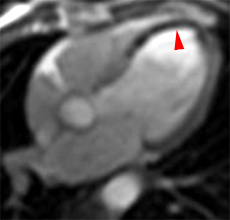
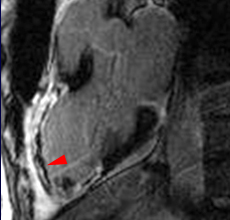
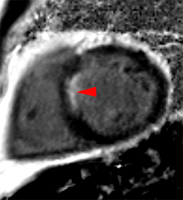
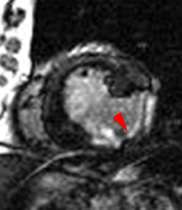
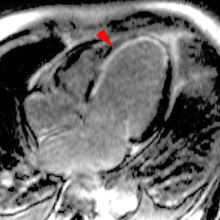
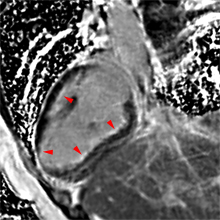
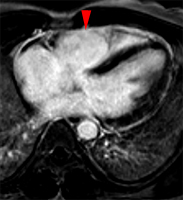
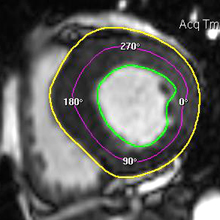
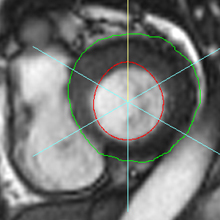
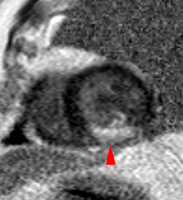
La répétition des acquisitions durant les 10 à 15 premières minutes qui suivent l’injection permet alors d’observer la chronologie des phénomènes propres aux différentes strates de tissus myocardique :1) rehaussement transitoire du signal dans le myocarde sain (maximum 1 mn après injection, puis décroissant),
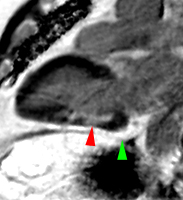
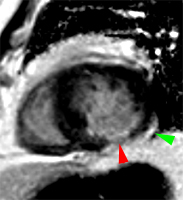
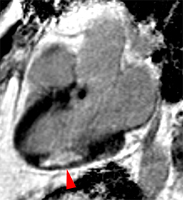
2) rehaussement progressif et plus intense de la zone correspondant au myocarde infarci, maximum 6 à 12 mn après injection ; c’est l’hypersignal tardif de l’infarctus (flèche jaune ci-contre).
3) éventuelle plage sous endocardique d’hyposignal persistant, centrant le territoire nécrosé (infarct core) et correspondant au no-reflow (flèche rouge ci-contre). |
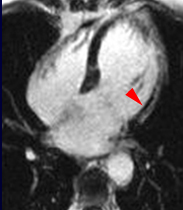
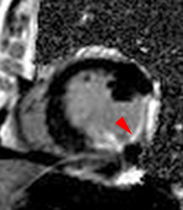
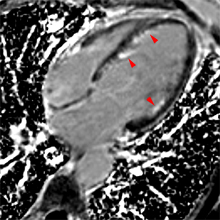
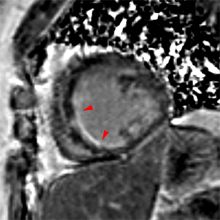
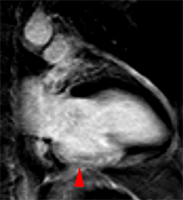
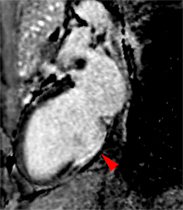
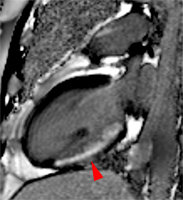
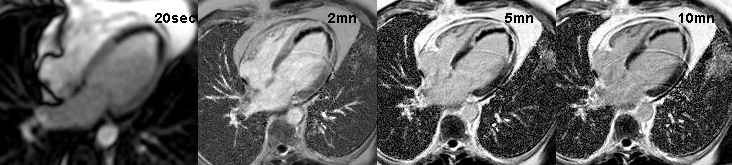 Exemple de no-reflow prolongé très étendu chez un patient avec large infarctus antérieur. Le defect de perfusion est caricatural dès le premier passage (image de gauche à 20 s) jusque très tardivement, au-dela de 10mn, alors qu’apparait progressivement un large hypersignal périphérique entourant le croissant d’hyposignal du no-reflow.
Exemple de no-reflow prolongé très étendu chez un patient avec large infarctus antérieur. Le defect de perfusion est caricatural dès le premier passage (image de gauche à 20 s) jusque très tardivement, au-dela de 10mn, alors qu’apparait progressivement un large hypersignal périphérique entourant le croissant d’hyposignal du no-reflow.
Différences entre les aspects échographiques et IRM
Echographie et IRM visualisent le no-reflow dans des proportion similaires, chez 25 à 30% des patients revascularisés). Par contre la prévalence paraît bien plus élevée lors des études chez l’animal (sauf pour les tout petits infarctus). En réalité, il doit exister tout un continuum de lésions de no-reflow au sein de l’infarctus aigu, plus ou moins facile à détecter selon la méthode d’examen utilisée et selon les conditions de mesure. Les agents de contraste intravasculaires (par exemple les microbulles de 2 à 10 micron de diamètre) sont plus sensibles que les petites molécules diffusibles (chélates de gadolinium) pour objectiver ces défaut de perfusion car ces derniers se distribuent aussi dans l’espace interstitiel (imbibition de proche en proche comme dans une éponge). Ainsi, dans des conditions de mesure identiques, il a été montré que le défaut de perfusion échographique lié au no-reflow était presque 2 fois plus étendu que le défaut de prise de contraste en IRM (Wu 1998 [6]). Pour l’immédiat, en attendant les agents de contraste échographiques de nouvelle génération (ne requérant pas la voie intracoronaire), l’IRM garde l’avantage de son caractère non invasif et de son large champ de vue, non dépendant de fenêtres acoustiques restrictives.
Prévalence et signification pronostique délétère du no-reflow
Prévalence :
Dans l’infarctus expérimental reperfusé à la 90ème minute, chez l’animal, l’hyposignal précoce est observé dans presque tous les cas, dans les heures ou les jours qui suivent, sauf si la taille de l’infarctus est inférieure à 2,5% du myocarde. La part du no-reflow par rapport à la taille de l’infarctus s’accroît : de 13% à la 2ème heure vers 30% au 2ème jour. Ce phénomène reste stable entre le 2ème et le 9ème jour de l’infarctus.
Chez l’homme, les prévalences rapportées d’hyposignal précoce en IRM sont de 25% à 40%. Dans le travail de Lund 2004 [7], un no-reflow est observé chez 38% des patients. La taille de l’infarctus, jugée d’après l’étendue de l’hypersignal tardif et de la lacune scintigraphique ainsi que d’après l’élévation enzymatique, est plus importante en cas de no-reflow qu’en l’absence de no-reflow (30% vs 15% de la masse myocardique).
L’importance du no-reflow s’accroit à mesure que la durée de l’occlusion coronaire augmente (ce qui s’associe à une plus grande extension transmurale de l’infarctus). Une forte corrélation entre durée d’occlusion et prévalence de no-reflow a ainsi été rapporté par Tarantini 2005 [8] . 64 patients avec IDM antérieur récent, traités par PCI, ont été étudiés. Un no-reflow sévère (tardif et non pas au premier passage) est observé dans 39% des cas en moyenne. Cette prévalence est d’environ 20% si l’occlusion est de 2 h et progresse vers 80% si l’occlusion dépasse 8h.
Signification pronostique :
Le no-reflow n’est pas seulement un concept physiopathologique mais constitue un indice de gravité et un ennemi à combattre car il conditionne la dilatation et l’hypokinésie du VG à distance de l’infarctus.
Les travaux d’échographie et d’IRM indiquent qu’en cas de no-reflow, la récupération myocardique sera moins favorable. Dans ce cas, le diamètre du VG augmente à distance tandis que la récupération de la FEVG est beaucoup plus faible que chez les patients exempts de no-reflow. Le pronostic clinique est également moins bon chez ces patients (plus de troubles du rythme, d’insuffisance cardiaque et d’épanchements péricardiques secondaires). Quarante quatre patients étudiés en IRM après infarctus aigu (J10±6) ont été suivi durant 16±5 mois (Wu 1998 [9]). Les évènements graves (mort, infarctus, angor instable, défaillance cardiaque et AVC) sont survenus chez 45% des patients présentant un no-reflow (11/44 pts) vs chez 9% seulement des patients n’ayant pas de no-reflow (p<0,01).
Quelles implications thérapeutiques peut-on en tirer ? Pour l’heure, de rares travaux laissent penser que les lésions microvasculaires de l’infarctus reperfusé pourraient être atténuées par le Vérapamil, l’adénosine ou les activateurs des canaux potassiques. En outre, l’influence favorable d’un préconditionnement est étayée par les résultats de l’équipe de l’hôpital Bichat qui a montré que le no-reflow échographique était moindre chez les patients qui présentaient un angor avant la survenue de leur infarctus.
Au total :
En pratique, il importe d’être conscient du fait que la recanalisation d’une artère occluse n’est pas suffisante pour empêcher un phénomène délétère de non reperfusion tissulaire à la phase aiguë d’un infarctus du myocarde. Ce no-reflow correspond à la zone centrale de l’infarctus, là où les dégâts tissulaires et surtout capillaires sont maximaux. La destruction endothéliale conduit à une obstruction microvasculaire qui s’oppose à la reperfusion durant les premières semaines de l’infarctus. Ce phénomène est vraisemblablement fréquent au centre de la nécrose myocardique où il occupe environ un tiers du tissu nécrosé mais sa prévalence est variablement appréciée, selon les conditions de mesure et le type d’agent de contraste utilisé en échocardiographie ou en IRM. L’étendue du no-reflow est un indice péjoratif qui dicte une moins bonne récupération fonctionnelle. Aussi, faut-il peut-être considérer, qu’au delà de la recanalisation coronaire, un nouvel objectif thérapeutique est de préserver les tissus menacés par des agents pharmacologiques qui restent à découvrir.
| Pour résumer :- hyposignal précoce (plus ou moins persistant) = no reflow = zone centrale infarcie dictant un mauvais pronostic.
– hypersignal tardif = ensemble du territoire touché par l’infarctus (taille de l’infarctus). |