Tagging : synchronisation et rotation
Etude du synchronisme de contraction
La dispersion des temps de contraction maximale est étudiée depuis longtemps en ventriculographie isotopique. Les anomalies les plus caricaturales sont représentées par les troubles conductionnels intraventriculaires et par les mouvements dyskinétiques des anévrysmes (la gamma angiographie est notamment utilisée pour la recherche d’anomalie de phase dans le cadre de la dysplasie du VD). Une stimulation cardiaque multisite est actuellement proposée dans le but de corriger les perturbations du synchronisme chez les patients en insuffisance cardiaque dont les QRS sont élargis au dela de 120 ms. L’échographie (DTI et speckle tracking) a été proposée comme indicateur complémentaire pour la resynchrosnisation. Le principe consiste à quantifier les écarts de temps de contraction entre différents segments myocardique.
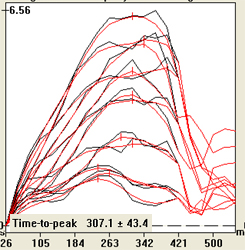 ‘ ‘ |
Le tagging permet également cette quantification en considérant un indice d’asynchronisme correspondant à l’écart type du temps de contraction maximale dans différents segments.L’exemple ci-contre illustre la méthode utilisée. On considère un paramètre de déformation ou de déplacement dans plusieurs segments myocardiques (12 segments par exemple sur la figure ci-contre). Après filtrage des données (afin de lisser le bruit), le sommet de chaque courbe est identifié ainsi que le temps correspondant (time to peak). L’écart type du time to peak (exprimé en ms) constitue l’indicateur habituellement utilisé pour quantifier l’asynchronisme de contraction.
Ces indices ont été étudiés chez l’animal par Helm 2005 [1]. En utilisant le déplacement radial (ajusté), l’équipe de Birmingham a ainsi montré que l’indice d’asynchronisme normal est de 22±6 ms (Foley 2009 [2]). |
Un indice d’asynchronisme > 110 ms est un prédicteur indépendant de mortalité ou d’événement cardiaque majeur dans les deux ans chez les insuffisants cardiaques éligibles pour une resynchronisation (Chalil 2007 [3]. Ces résultats ont été confimé par Leyva 2009 [4]) qui montre également une forte valeur prédictive des séquelles d’infarctus postérolatéral (gadolinium) et de l’insuffisance rénale chez ces patients. Les auteurs remarquent que cet indice s’accroît à mesure que la largeur du QRS augmente chez les patients insuffisants cardiaques, en étant bien corrélé aux volumes VG et à la chute de la FEVG.
Rotations et torsions liées à l’architecture complexe des fibres myocardiques
Les dessins et gravures du 18eme siècle montraient déjà très clairement la disposition obliques de fibres myocardiques. 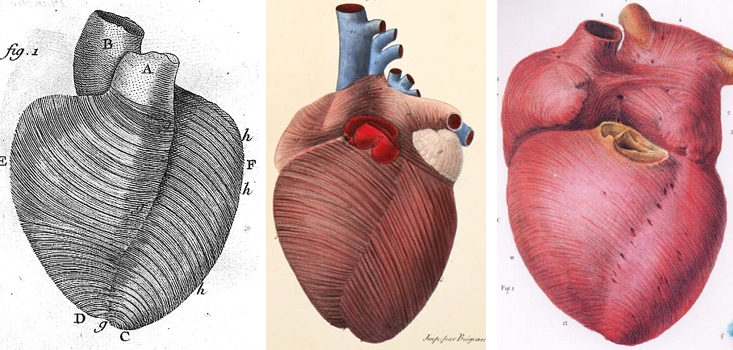
| SÉNAC, Jean Baptiste, Ed. Briasson, 1749. BIUM Paris [5] | ANTOMMARCHI, Francesco, Ed. C. de Lasteyrie, 1826. BIUM Paris [6] | JM BOURGERY (1797-1849) et NH JACOB, Ed. JM LE MINOR & H SICK, TASCHEN |
Outre ces pertinentes observations anatomiques, d’anciens travaux d’histologie sur l’architecture 3D des fibres myocardique (Streeter 1969 [7]), confirmés par des travaux récents de tractographie par IRM de diffusion (Sosnovik 2009 [8]) ont révélé l’organisation complexe des fibres, spiroïdes, obliques, en hélice avec plusieurs couches sous endocardique et sous épicardiques perpendiculaires entre elles. L’arrangement des fibres change graduellement depuis une disposition en hélice sous endocardique dirigée vers la droite vers une hélice sous épicardique dirigée vers la gauche, en passant par une couche médiopariétale de fibres circulaires.
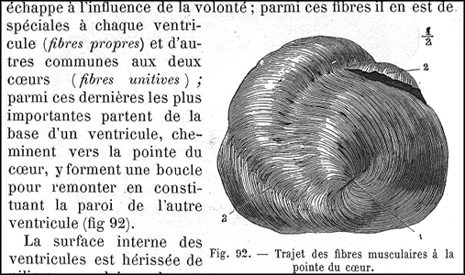 |
La théorie du muscle en bande déjà illustrée dans les manuels de la fin du 19eme siècle, explique que les 2 ventricules résultent de l’enroulement d’une bande continue de muscle (Song 2009 [9] – cf : helicalheart.com [10]). Anatomie et physiologie animales, par Mathias Duval,… et Paul Constantin,… ouvrage rédigé conformément aux programmes officiels du 28 janvier 1890 pour la classe de philosophie et à ceux du 15 juin 1891 pour l’enseignement secondaire moderne Edition : Paris : J.-B. Baillière et fils, 1892 BIUM Paris [11] |
Cette géométrie explique les mouvements de rotation dans le plan petit axe (cf : figures 3 et 6) s’effectuant dans le sens horaire à la base et dans le sens anti-horaire à l’apex (lorsque le cœur est vue par l’apex) – cf Rüssel 2009 [12], Esch 2009 [13], Sengupta 2008 [14]. On peut donner une image de ce phénomène en imaginant tenir la coupe basale avec la main gauche et la coupe apicale avec la main droite ; la torsion qui s’effectue en systole (twist) correspond à un mouvement de dévissage entre les deux main (comme si on veut dévisser un bouchon ou ouvrir un robinet). La détorsion (untwist ou recoil) qui s’effectue lors de la période de relaxation isovolumique semble être un indice important qui conditionne le remplissage VG. Ces données, corroborées par le speckle tracking en échographie sont analysées en détail dans le travail de Buckberg 2008 [15] intitulé « la mécanique cardiaque revisitée ».
 |
|
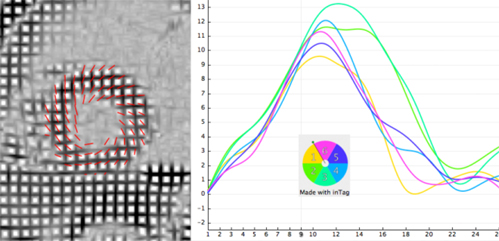 |
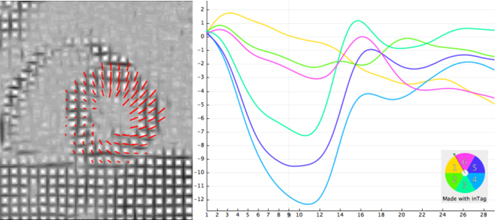
Illustration des mouvements de rotation opposés entre la base et l’apex. La ligne du haut correspond à une coupe basale et la ligne du bas correspond à une coupe apicale. A gauche sont présentées les ciné et les images de tagging protosystolique sur lesquelles sont superposés les vecteurs du champ de déplacement (traits rouges). A droite figurent les graphiques de l’angle de rotation correspondant dans 6 secteurs myocardiques. Les vecteurs de déplacement sont incurvés dans le sens horaire sur la coupe basale avec une rotation très hétérogène (quasi inexistante au niveau septal), de l’ordre de -7° en moyenne. Sur la coupe apicale, au contraire, les vecteurs sont incurvés selon une direction anti-horaire de manière beaucoup plus homogène qu’à la base (de l’ordre de 11° ici). La différence entre rotation à la base (angle négatif) et à l’apex (angle positif) correspond à la torsion.
Le mouvements de rotation sont plus marqués dans le sous endocarde que dans le sous épicarde. Les angles de rotation, résumés dans le tableau I, sont de l’ordre de -7° à la base (horaire) et +8° à l’apex (antihoraire). Certains auteurs ont proposé de normaliser la torsion par la longueur du ventricule gauche et la durée du cycle cardiaque (Takahashi 2010 [16]).
| Angle de rotation | Base (horaire) | Apex (anti-horaire) |
| Nagel 2000 [17] | -4.4±1.6° | 6.8±2.5° |
| Fuchs 2003 [18] | -9.5±2.0° | 3.3±1.0° |
| Maier 1992 [19] | -5.0±2.4° | 9.6±2.9° |
| Helle-Valle 2005 [20] | -11.6±3.8° | 4.8±1.7° |
| Kanzaki 2006 [21]. | -2.6±1.6° | 11.2±2.5° |
| Goffinet 2009 [22] | -3±2° | 13±7° |
Tableau I : angles de rotation observés avec le tagging chez des sujets normaux dans une coupe basale et dans une coupe apicale
La différence de rotation entre base et pointe correspond à la torsion (twist), de l’ordre de 12.6±1.5° (Lorenz 2000 [23]). Il existe également un mouvement de rotation par rapport au grand axe (« rocking motion » (Oh 2009 [24]).
Hétérogénéité physiologique du strain
Les hétérogénéités du strain révélées par le tagging sont résumées dans le travail de Moore 2000 [25] et les articles de revue de l’équipe hollandaise de Gotte et al (Gotte 2006 [26]) et de la Johns Hopkins University (Shehata 2009 [27]).
– De la base vers la pointe : les déformations circonférentielles et longitudinales s’accroissent, alors que, au contraire, le déplacement de la base vers le bas et plus important que le soulèvement de l’apex en systole. Cette apparente discordance dans le gradient base-pointe souligne le fait qu’il ne faut pas confondre mouvement de déplacement (plus fort à la base) et de déformation locale ou strain (plus fort à l’apex).
– De l’épicarde vers l’endocarde : les déformations circonférentielles, longitudinales et radiales s’accroissent.
– Selon les segments : les déformations circonférentielles (et longitudinales) sont les plus marquées en latéral et les plus faibles en septal.
– La chronologie de l’activation mécanique débute d’abord dans la paroi latérale ; le septum s’active en dernier. A contrario, le pic de contraction est d’abord atteint par le septum puis par la paroi latérale.
– selon l’age : le pic de rotation et de torsion est plus marqué et plus prolongé chez les sujets âgés (Oxenham 2003 [28]).
Comparaison entre tagging IRM et speckle tracknig échographique
Peu de comparaisons directes ont été effectuées entre ces deux techniques. Accessibilité de la technique (au lit du malade) et résolution temporelle constituent des avantages certains pour l’outil échographique. Cho 2006 [29] rapporte des corrélations assez modestes entre les indices homologues IRM et echographiques. L’accroissement du strain de la base vers l’apex et de l’épicarde vers l’endocarde a été rapporté en échographie (Leitman 2010 [30]) comme en IRM. Cependant, les hétérogénités régionales (septum < paroi latérale) semblent être plus marquées en IRM qu’en échographie où le strain apparaît plus homogène. La rotation apicale du VG est sous estimée en speckle tracking par rapport au Tagging car l’échographie ne considère pas les coupes les plus apicales (cf : Goffinet 2009 [31], Helle-Valle 2005 [32] 11.6±3.8° en IRM vs 10.9±3.3° en échographie).
Concernant le synchronisme de contraction les valeurs extraites du strain radial 19.2±14.6 (Ng 2008 [33]) se comparent bien aux valeurs rapportées en IRM (22±6 ms, voir supra). Les valeurs extraites du strain longitudinal sont plus dispersées (40.4±11.8 ms pour Ng, 28.9±23 pour Conca 2009 [34], 46±5 ms env. pour Miyazaki 2008 [35]) ; sachant qu’au dela du seuil de 60 ms on considère que la réponse à la resynchronisation ventriculaire serait plus favorable (Gorcsan 2008 [36], Mele 2006 [37]). Pour Bertola 2009 [38] le strain circonférentiel (avec analyse de l’uniformité par méthode de Fourier) serait plus pertinent que le strain longitudinal ou radial.