Concept de viabilité myocardique
La question de la viabilité myocardique se pose en cas d’akinésie de contraction segmentaire en rapport avec une sténose ou une occlusion coronaire, lorsqu’il s’agit de déterminer si une revascularisation coronaire pourrait permettre ou non de restaurer la fonction contractile.
Cette question peut se poser dans le cadre de la sidération myocardique, phénomène transitoire, spontanément réversible après occlusion coronaire plus ou moins brève (Braunwald et Kloner 1982 [1]) ou dans le cadre du myocarde hibernant décrit par Rahimtoola en 1989 [2].
Dans ce contexte, les critères reconnus de viabilité – définie par l’amélioration de la contraction segmentaire après angioplastie ou pontage – sont de trois types ([3]):
1) persistance d’un métabolisme tissulaire alors que la fonction contractile et la perfusion sont diminuées (métabolisme du FDG préservé en PET, fixation tardive de Thallium en SPECT),
2) amélioration de la contraction segmentaire objectivable sous petites doses de Dobutamine en échographie (ou en IRM – cf Baer 1998 [4], Aayad 1998 avec tagging [5]). Pour Barmeyer 2008 [6] ayant étudié 50 patients post-IDM, un épaississement systolique de plus de 2mm sous dobutamine (10 gamma/kg/mn) est le meilleur indice de récupérabilité fonctionnelle à 6 mois.
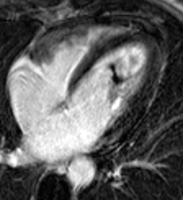
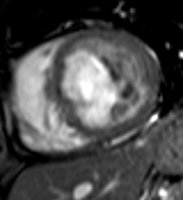
3) absence d’hypersignal tardif post-gadolinium de la zone akinétique (white is dead).
En outre, l’indicateur le plus simple de non viabilité est l’amincissement pariétal à moins de 6 mm [7].
Hypersignal tardif post-gadolinium = tissu myocardique mort, irrécupérable
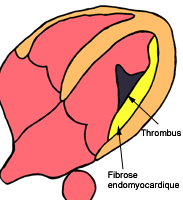
Le mécanisme qui rend compte de l’hypersignal tardif post-gadolinium correspond à un acroissement de l’espace extracellulaire où se distribuent les chélates de gadolinium (myomalacie à la phase aigue, fibrose à la phase tardive de l’infarctus). De surcroit, la raréfaction des capillaires entraine une réductiion du wash-out qui explique la persistance d’un contraste tissulaire plus de 10 mn apres injection par rapport au tissu sain adjacent
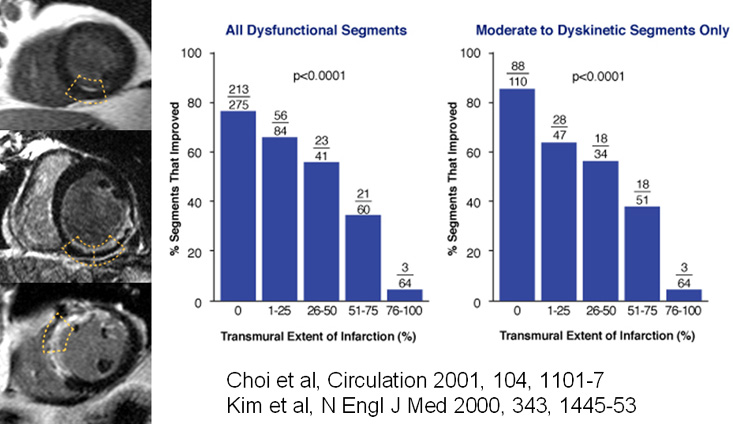
En pratique, l’étude de l’hypersignal tardif post-gadolinium apparait comme une technique très pratique et aisée à réaliser. Ses fondements ont été apportés par de multiples travaux réalisés par Kim 2000 [8], Choi 2001 [9], Selvayanagam 2004 [10]… En cas de dysfonction segmentaire post-infarctus, la probabilité d’amélioration contractile post-revascularisation décroit à mesure que l’extension de l’hypersignal post-gadolinium devient transmurale comme le montre le graphique ci-dessous. L’analyse de l’étendue transmurale de l’hypersignal est également prédictive de la récupération spontanée dans le myocarde sidéré (Beek 2003 [11]).
La limite de cette approche concerne la situation -fréquente – où l’hypersignal intéresse approximativement la moitié de l’épaisseur du myocarde, auquel cas les chances de viabilité sont intermédiaires (50%). Dans ces situations délicates, il a été suggéré de recourir à l’étude de la contraction sous Dobutamine pour départager les situations qui méritent une revascularisation des autres cas où une revascularisation est inutile.