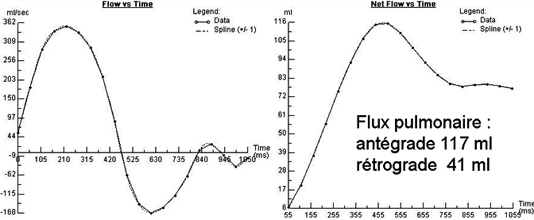
| Guidelines et Appropriateness criteria
Deux catégories de textes discutent des bonnes indications des examens complémentaires cardiaque et en particulier de l’IRM cardiaque. Il s’agit d’une part des guidelines ou recommandations des sociétés savantes américaines (ACC/AHA [1] – Imagerie [2]), européennes (ESC [3]) et nationales (SFC [4] ainsi que les textes de l’HAS en France [5]). Ces recommandations résultent surtout des enseignements des grandes études cliniques (ou, en l’absence d’étude formelle, de consensus d’experts). Ces recommandations sont centrées sur des catégories de pathologies comme la maladie coronaire, les cardiomyopathies…. Elles sont listées dans le tableau ci-dessous. D’autre part les textes consacrés aux ‘critères appropriés’ édités par l’American College of Cardiology Foundation rapportent les bonnes indications à partir des usages actuels et prévus, tout en respectant les recommandations. Ces propositions se veulent plus pragmatiques que les guidelines, dans le but de guider le prescripteur vers de bonnes pratiques cliniques, avec le souci de minimiser les inconvénients pour les patients et les coûts de santé. Ces ‘bonnes indications’ proposées pour l’échographie de stress, la scintigraphie, l’IRM et le scanner cardiaque sont résumées page suivante. |
 |
| Atlas d’anatomie et de chirurgie de JM BOURGERY (1797-1849) et NH JACOB, édité par JM LE MINOR & H SICK, TASCHEN. |
Liste des recommandations
Le tableau ci-dessous collige les liens vers les recommandations de la société française de cardiologie, de l’ESC et de l’ACC/AHA, pouvant concerner l’imagerie cardiaque (liste établie début 2009).
| Thème | SFC | ESC | ACC/AHA |
| Angor stable | [6] | [7] | |
| SCA / NSTEMI | [8] | [9] | |
| Infarctus / STEMI | [10] | [11] | [12] |
| Insuffisance cardiaque chronique | [13] | [14] | [15] |
| Cardiomyopathies hypertrophiques | [16] | [17] | |
| Valvulopathies | [18] | [19] | [20] |
| Maladies du péricarde | [21] | ||
| Cardiopathies congénitales de l’adulte | [22] | [23] | |
| Bilan cardiaque peri-opératoire | [24] | ||
| Prévention dans la maladie athéromateuse | [25] | [26] | |
| Epreuve d’effort | [27] | [28] | |
| Echocardiographie | [29] | [30] | |
| Cardiologie nucléaire | [31] | [32] | |
| Angioplastie-stents coronaires (PCI) | [33] | [34] | [35] |
| Pontages coronaires | [36] | ||
| Scanner cardiaque | [37] | [38] | [39], [40] |
| IRM cardiaque | [41] | [42] |
Résumé des indications
La liste ci-dessous, inspirée d’un rapport de consensus du groupe de travail de l’European Society of Cardiology sur l’IRM cardiaque, publié en 2004 [43], résume les principales indications actuelles.
| Indication | Intérêt | Commentaire |
| Fonction VG & VD | référence | Quantification des volumes, masse VG et indices de fonction glob. & segmentaires |
| Valsalva / aorte | +++ | Dimensions aortiques (ciné), bicuspidie, fuite valvulaire, paroi aortique |
| Infarctus détection Infarctus extension Infarctus viabilité |
+++ ++ +++ |
Identification de petites lésions indétectables autrement Extension de l’IDM, thrombus, complications mécaniques Bilan de viabilité myocardique des segments dysfonctionnels (white is dead) |
| Détection de l’ischémie | ++ | Accessible par perfusion-dipyridamole ou ciné-dobutamine (centres experts) |
| Valvulopathies | ++ | Quantification des régurgitations aortiques et pulmonaires (ex : Fallot opéré) |
| Myocardites | +++ | Rôle crucial dans le diagnostic étiologique des ‘SCA’ à coronaires normales |
| Tumeurs & masses | +++ | Complément très utile à l’echographie (contexte préop. notamment) |
| Dysplasie du VD | +++ | Complément à l’échographie mais aspécifique et trier les indications ++ |
| CMH | ++ | Surtout si apicale et intérêt de la rétention de gadolinium ++ |
| CMD | ++ | Arguments intéressants de distinction entre ischémique vs primitif |
| CMR | ++ | Diagnostic différentiel vs peric. constrictive, fibrose endomyocardique |
| Péricardite constrictive | +++ | Epaisseur péricardique, cavités, ‘couplage ventriculaire pathologique’ |
| Surcharge en fer | ++ | Séquences spécifiques ‘thalassémie’ (patho. si T2*<20 ms) |
| Maladies de système | ++ | Détection d’atteinte myocardique (gado) dans sarcoidose, collagénoses… |
| CIA | ++ | Complément utile à l’écho : orifice, berges, Qp/Qs, RVPA |
| Congénital adulte | ++ | Beaucoup d’informations complémentaires à l’écho (morpho, fonction, flux) |
Concernant les cardiopathies congénitales de l’adulte, on pourra se référer au texte de l’European Society of Cardiology [44],