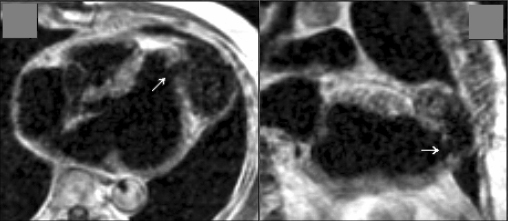
« Dilatation progressive, fusifome, de l’aorte ascendante, dont le calibre est normal au niveau des sinus de Valsalva mais qui atteint 48 mm à mi-hauteur. Le tronc de l’artère pulmonaire est également fortement dilaté chez ce patient. «
Maladie annulo-ectasiante
La maladie annulo-ectasiante se caractérise par une dilatation prédominant au niveau des sinus de Valsalva, contrairement aux anévrysmes fusiformes où la dilatation de cailbre est progressive, avec effacement de la jonction sino-tubulaire.
Le diamètre normal au niveau des sinus de Vasalva est de moins de 40 mm.
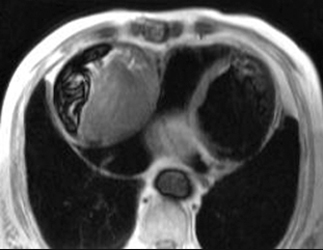
« Maladie annulo-ectasiante à 47 mm avec bicuspidie aortique et gradient systolique maxi (écho-doppler) à 60 mmHg chez une patiente de 55 ans. «
Anévrysmes aortiques
L’anévrysme aortique correspond à une dilatation pathologique du calibre avec perte du parallélisme des bords.
Complémentarité entre imagerie synchronisée et angio-IRM
| « L’imagerie synchronisée (ciné à gauche) est la technique la mieux adaptée pour mesurer les dimensions aortique et pour apprécier une régurgitation valvulaire mais l’angio-IRM avec injection de gadolinium (à droite) constitue un complément d’examen indispensable pour l’’exploration des troncs supra-aortiques (montrant par exemple ici l’existence d’un tronc bicarotidien court). « |
En présence d’une dilatation de l’aorte ascendante, deux éléments ne doivent pas être oubliés :
1) toujours penser à rechercher une bicuspidie
Aorte dystrophique avec dilatation fusiforme du segment ascendant atteignant au maximum 44 mm en transverse x 41 mm en antéro-postérieur (sur le 3ème ciné en partant de la gauche, à mi-hauteur de l’aorte ascendante). La coupe passant par le plan valvulaire montre une bicuspidie et les ciné de gauche montrent des perturbations systoliques de flux dans l’aorte initiale en faveur d’une sténose aortique. Noter l’effacement de la jonction sino-tubulaire.
2) rechercher une possible insuffisance aortique
….en recourant aux incidence sagittale oblique ‘parasternale grand axe’ et frontale :
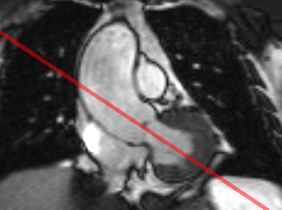 |
« Anévrysme fusiforme de l’aorte ascendante mesurant au maximum 51 mm en antéro-postérieur (incidence OAG à gauche) et 46 mm en transverse (vue frontale au milieu), avec effacement de la jonction sino-tubulaire. L’incidence ‘parasternale grand axe’, similaire à l’incidence échogardiographique, sélectionnée à partir de la vue frontale (ligne rouge), est un complément utile pour explorer la voie d’éjection gauche et rechercher une fuite aortique (jet fin venant de réfléchir contre la grande valve mitrale en diastole sur le ciné à droite). «
Aorte thoracique/ Mesures
Méthode de mesure de l’aorte thoracique
L’IRM est une excellente méthode d’examen pour l’aorte thoracique. L’angio-IRM avec injection de gadolinium est très efficace pour l’examen de la crosse aortique et des troncs supra-aortiques. Cependant, l’étude de l’aorte initiale et de la valve aortique est mieux réalisée en imagerie ciné synchronisée à l’ECG car il s’agit de structures mobiles, animées par les battements cardiaques et le flux d’éjection systolique. Le ciné IRM offre l’avantage de montrer les mouvements des structures et de donner une indication sur les flux pathologiques, comparativement au turbo spin écho qui donne une image statique ‘sang noir’. L’écho de spin montre cependant mieux les parois vasculaires.
Les dimensions aortiques comptent parmi les critères essentiels pour décider d’un geste opératoire en cas d’anévrysme aortique mais l’évolutivité chronologique des lésions constitue également un indice de décision important. Afin de minimiser les variabilités inter et intra-observateurs, il importe d’appliquer une méthodologie rigoureuse pour prendre les dimensions aortiques.
Les mesures sont faites en diastole (le calibre s’expanse légèrement en systole). Les points de mesures qu’il convient de rapporter dans le compte rendu d’examen sont :
– le diamètre de l’anneau aortique (à l’insertion des sigmoïdes aortiques), à effectuer sur une incidence frontale (ci-dessous). Ce diamètre est normalement de 27 à 32 mm et correspond au diamètre de l’anneau prothétique qui serait implanté en cas de remplacement valvulaire. Le numéro utilisé dans la nomenclature des prothèses valvulaire correspond à ce diamètre ; par exemple on parle de valve de Bjork N°29 ou de St Jude N°30 (sachant que la surface fonctionnelle d’écoulement est sensiblement plus petite que celle indiquée par ce diamètre).
– Le diamètre aortique au niveau des sinus de Valsalva. On indique le diamètre le plus grand.
– le diamètre aortique à la jonction sino-tubulaire et au niveau du segment ascendant moyen (à mi hauteur de l’aorte ascendante) et éventuellement avant l’origine du tronc artériel.
– Diamètre de la crosse aortique (en transverse sur des coupes axiales) et en cranio-caudal sur des coupes OAG.
– En cas de dilatation, le diamètre de l’aorte descendante supra, retro et infra-cardiaque (jonction thoraco-abdominale).
Incidence frontale pour la mesure de l’aorte initiale :
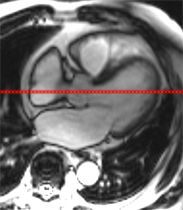 |
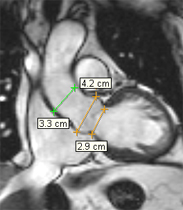 |
Un plan frontal passant par le milieu de l’anneau aortique est sélectionné afin de mesurer les principaux segments de l’aorte initiale.
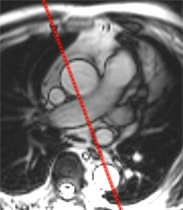
Incidence sagittale oblique (OAG), enfilant l’aorte thoracique et la crosse :
 |
 |
Si l’aorte est tortueuse, il n’existe pas de plan de coupe passant par l’ensemble de son déroulement et une approche segmentaire est alors nécessaire (un plan sur le partie basse et un autre plan sur la crosse aortique par exemple.
Incidences axiales obliques perpendiculaires au grand axe de l’aorte :
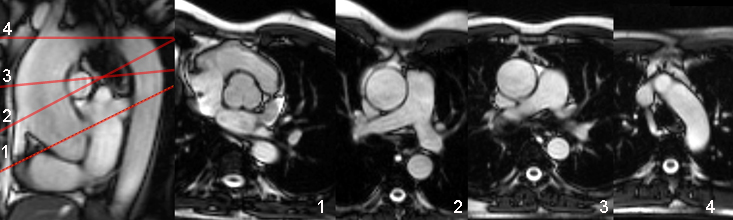 |
S’il existe un doute sur la justesse des mesures sur les incidences précédentes, un ensemble de coupes horizontales obliques, perpendiculaires au grand axe de l’aorte donne une meilleure assurance de mesures précises. Cette illustration montre comment sont sélectionnés les plans les plus importants correspondant 1) aux sinus de Valsalva, 2) à la jonction sino-tubulaire (qui est effacée chez ce patient), 3) au segment ascendant moyen et 4) à la portion horizontale de la crosse.
Deux pièges doivent être évités :
– Surestimation à partir de mesures réalisées sur des coupes axiales lorsque l’aorte est déroulée (non pas perpendiculaire mais oblique dans le plan de coupe). Il est impératif de ne pas s’arrêter aux seules coupes axiales pour étudier l’aorte ascendante +++.
– sous estimation par effet de volume partiel si le plan de coupe ne passe pas au milieu de la lumière mais est tangente sur un bord.
De manière générale les mesures doivent toujours être réalisée PERPENDICULAIREMENT aux parois, en recherchant le plan de coupe ad hoc (cf : illustration) et en corroborant une mesure par une autre faite dans un plan perpendiculaire
Dimensions normales de l’aorte thoracique : ….
Aorte/Introduction
L’étude de l’aorte constitue une indication classique de routine en IRM cardio-vasculaire.
Plan du chapitre :
| L’aspect de l’aorte normale en IRM est présenté en première partie.La pathologie la plus commune est représentée par les anévrysmes aortiques. La dilatation isolée des sinus de Valsalva : maladie annulo-ectasiante, les anévrysmes fusiformes ou de la crosse, les dystrophies aortiques diffuses sont illustrées. Une mention particulière concerne la maladie de Marfan.
Les hématomes de paroi sont moins fréquents ; ils constituent une forme débutante de dissection aortique. Ces pathologies s’inscrivent donc généralement dans un contexte d’urgence chirurgicale; raison pour laquelle le scanner – plus accessible – supplante l’IRM dans ces indications. L’IRM garde cependant une place conséquente pour le suivi évolutif des dissections de l’aorte ascendante opérées et pour les dissections de l’aorte descendante. La coarctation aortique est remarquablement bien mise en évidence avec l’IRM qui est également bien adaptée pour le suivi post-opératoire ; notamment pour la recherche des deux complcations qui sont la recoarctation et l’anévrysme anastomotique. Les artérites inflammatoires, dominées par la maladie de Takayasu entrainent des anomalie de la paroi aortique acessibles en IRM et peuvent conduire à des sténose, des occlusions ou des ectasies vasculaires. |
 |
| The anatomy of the arteries of the human body…Quain Richard, Maclise Joseph illustrator, 1844 – Collections of the US National Library of Medicine [1] |
| Aorte normale | Maladie annulo-ectasiante | Anévrysmes aortiques |
| Disections aortiques | Coarctation aortique | Aortite |
Péricarde/Résumé du chapitre
IRM DES ATTEINTES PERICARDIQUES – ELEMENTS A RETENIR
– La péricardite (inflammation) et la myopéricardites sont objectivées grâce au rehaussement du signal des feuillets péricardiques après injection de gadolinium.
– Epanchements liquidien = hyposignal T1 et hypersignal en écho de gradient ciné.
– L’écrasement cyclique de la paroi de l’OD n’est pas un signe de tamponnade mais la perte de compliance de la VCI (temps réel en inspiration) est un signe de mauvaise tolérance hémodynamique.
– Hémorragies péricardiques = signal hétérogène dans toutes les pondérations.
– L’IRM est utile dans la recherche étiologique d’un épanchement (tumeurs).
– Il est facile de distinguer liquide et tissu graisseux en IRM.
– Péricarde > 4 mm, en hyposignal T1 et hyposignal en écho de gradient ciné, signe un épaississement pathologique.
– L’IRM ne peut pas différencier fibrose et calcification et le rôle du scanner est crucial dans les épaississements péricardiques (calcifications).
– Epaississement péricardique (anatomie) ne signifie pas constriction (physiopathologie) dont le diagnostic repose sur la recherche d’un couplage ventriculaire pathologique (temps réel en inspiration).
– Les métastases cardiaques et péricardiques sont beaucoup plus fréquentes que les tumeurs primitives (dont la principale est l’angiosarcome).
Péricarde/Masses pseudo-tumorales
FAUX-ANEVRYSMES ET DIVERTICULES DU VENTRICULE GAUCHE
Les faux anévrysmes du ventricule gauche résultent généralement de la rupture ou de la fissuration d’une paroi libre du VG en péricarde cloisonné d’origine ischémique (complication mécanique de l’infarctus). Il en résulte une poche ou un sac anévrysmal raccordé au ventricule gauche par un collet. La distinction avec un anévrysme ventriculaire vrai n’est pas toujours facile. Les critères de diagnostic sont rapportés par Konen 2005 [1].
Diagnostic différentiel : selon l’aspect IRM et le contexte clinique il faut également évoquer les fentes myocardiques ou cleft ainsi que les suspicion de fissuration ou diverticules ventriculaires.
ANEVRYSMES CORONAIRES
 |
|
| Bilan d’une masse péricardique anormale décelée en échographie. | Anévrysme de la coronaire droite avec portions thrombosées et portions circulantes’ |
Voir également les lésions induites par cathéter et l’Exemple de péricardite constrictive pseudotumorale
Péricarde/Tumeurs
TUMEURS CARDIAQUES BÉNIGNES IMPLIQUANT LE PERICARDE
Les tumeurs cardiaques bénignes (Araoz 2000 [1]) sont traitées dans un autre chapitre. Le variétés pouvant impliquer le péricarde sont :
| – Les LIPOMES sont les secondes tumeurs cardiaques bénignes les plus fréquentes après les myxomes. Ils présentent un aspect typique à contours régulier avec hypersignal caractéristique en écho de spin pondéré T1, compte tenu du T1 très court de la graisse. Plusieurs types de séquences (cf: voir distinction liquide/graisse) permettent d’affirmer le caractère lipidique de ces formations tumorales qui sont exceptionnellement obstructives ou compressives.Exemple de volumineux lipome de plus de 3 cm d’épaisseur, adossé à la paroi latérale du VG et remontant dans le médiastin gauche |  |
Fibromes, tératomes, paragangliomes et lymphangiomes sont évoqués dans le chapitre sur les tumeurs cardiaques.
TUMEURS CARDIAQUES MALIGNES IMPLIQUANT LE PERICARDE
– Les tumeurs cardiaques malignes (Araoz 1999 [2]) sont traitées dans un autre chapitre.
TUMEURS MALIGNES PRIMITIVES
Elles sont moins nombreuses que les tumeurs bénignes primitives puisque 25% seulement des tumeurs primitives sont malignes. Elles demeurent longtemps asymptomatiques jusqu’à ce que leur volume important ne soit la source de symptomes aspécifiques : dyspnée, insuffisance cardiaque ou troubles du rythme. De manière générale, les données d’imagerie – même si elles peuvent être suggestives – ne permettent pas un diagnostic précis et un prélèvement biopsique avec examen histopathologique sont nécessaires pour préciser la conduite à tenir thérapeutique (van Beek 2007 [3]).
Les LYMPHOMES cardiaques primitifs sont très rares comparativement aux lymphomes médiastinaux avec envahissement cardiaque et peuvent toucher les patients immunodéprimés. Ils sont habituellement non Hodgkinien, de type B, confinés au coeur ou au péricarde et intéressent le bord droit du coeur.
Le MESOTHELIOME péricardique dérive de cellules mésothéliales propres au péricarde et est distinct du mésothéliome pleural. Cette affection n’a pas de lien causal avec l’exposition à l’amiante. Elle s’exprime sous forme d’épaississement nodulaire du péricarde.
TUMEURS MALIGNES SECONDAIRES
Les métastases cardiaques (Chiles 2001 [4]) sont 20 à 40 fois plus fréquentes que les tumeurs malignes primitives mais les conséquences cardiaques sont généralement au second plan en comparaison des problèmes carcinologiques, sauf si un épanchement ou une hémorragie entraîne une tamponnade. Leur répercussion cardiaque principale résulte des épanchement péricardiques. Les métastase cardiaques sont en fait fréquentes mais généralement cliniquement méconnues ; elles sont découvertes à l’autopsie chez 10 à 12% des patients décédés de cancer (Wang 2003 [5]).
Les cancers broncho-pulmonaire et du sein, les mélanomes et les lymphomes sont les principaux responsables de métastases cardiaques. L’implication péricardique avec épanchement est fréquente. L’envahissement peut se faire par une des 4 voies : 1) extension lymphatique rétrograde, 2) diffusion hématogène, 3) extension par contiguité de voisinage et 4) extension par le drainage de retour veineux.
Les masses tumorales apparaissent en général en hyposignal T1 et en hypersignal T2, sauf les mélanomes qui présentent un hypersignal T1 en raison de composantes paramagnétiques liées à la mélanine. Un rehaussement de signal est habituellement observé après injection de gadolinium comme on peut le voir ci-dessous :
Métastase péricardique d’une tumeur de Grawitz
 |
Patient de 70 ans asymptomatique sur le plan cardiaque, bilanté en IRM en raison d’un thrombus cave inférieur découvert en échographie, compliquant un cancer du rein. Les coupes T1 axiales et le ciné en écho de gradient n’ont pas retrouvé de thrombose ni de masse tumorale de la veine cave inférieure. Par contre, on met en évidence une formation tumorale localisée dans le péricarde (flèche rouge) en arrière du sillon tricuspidien, épargnant la coronaire droite, en hyposignal, sans épanchement liquidien associé. Noter la présence d’un nodule pulmonaire métastatique (fléche verte) et le net rehaussement du signal de la masse tumorale après injection de gadolinium (ciné à droite).
Les épanchement péricardiques néoplasiques sont fréquents mais n’entrainent généralement que peu de symptômes en raison de leur constitution progressive avec peu de douleurs et sans fièvre. Il s’agit volontiers d’une découverte échographique ou scanographique.
Les hémorragies tumorales apparaissent en général en hypersignal T1. Outre l’épanchement péricardique on peut observer des épaississements, des nodularités ou des masse péricardiques venant rompre l’intégrité de la ligne péricardique physiologique.
TUMEURS PULMONAIRES OU MEDIASTINALES INTÉRESSANT LE PÉRICARDE
Lésion métastatique connexe au péricarde, sans envahissement péricardique
 |
|
 |
Bilan d’un nodule centimétrique découvert au scanner chez un patient de 52 ans présentant un hémangiopéricytome de la fosse iliaque droite. Il s’agit d’une tumeur vasculaire rare dérivée des cellules mésenchymateuses. Le nodule centimétrique siége derrière l’oreillet droite. L’aspect en hyposignal T1 et en hypersignal sur les séquences STIR pondérées T2 évoque en premier lieu une formation liquidienne ou kystique. Cependant l’hyposignal T1 est moins marqué que dans les formations kystiques habituelles et on note un leger rehaussement du signal sur l’écho de spin T1 post-gadolinium ainsi qu’un important rehaussement annuaire (tête de flèche) sur les images en inversion récupération GRE post-gadolinium, en faveur d’un structure tissulaire et non pas simplement kystique, avec probable centre nécrotique. Ces indices sont donc en faveur d’une probable extension métastatique de l’hémangiopéricytome mais sans signe d’envahissement péricardique sur ces clichés.
Tumeurs médiastinales ou pulmonaires paracardiaques, sans envahissement péricardique
Schématiquement, l’orientation diagnostique des masses médiastinales s’effectue à l’aide de compartiments délimités par des lignes séparant les étages antérieur – moyen – postérieur et supérieur – moyen – inférieur selon le graphique ci-dessous (cf: Sans N et al, Approche diagnostique des masses médiastinales. Encycl Méd Chir, Radiodiagnostic – Coeur-Poumons, 32-535-D-10, 2000, 18p)
| COMPARTIMENTATION DU MEDIASTIN | PRINCIPALES PATHOLOGIES SELON LE COMPARTIMENT |
 |
 |
| La tonalité du signal en fonction des pondérations T1 et T2 oriente sur le type de masse mais ne permet pas un diagnostic étiologique précis. |  |
L’IRM est considéré comme une indication de classe I dans la recherche de cause tumorale pour une lésion péricardique selon le groupe de travail de la Société Européenne de Cardiologie (Europ H J 2004, 25, 1940-65 [6] )
Autres lésions péricardiques
Les autres catégories de pathologie péricardique à considérer sont :
KYSTES PLEURO-PERICARDIQUES (mésothelial)
Il s’agit de kystes congénitaux correspondant à une portion du péricarde dévié durant le développement embryologique. La paroi est mince, sans septa interne. Le contenu liquidien pauvre en proteine dicte l’aspect caractéristique en hyposignal T1 et en hypersignal T2 homogène, sans rehaussement de signal sur les séquences T1 post-gadolinium. Rarement, un contenu plus riche en protéines peut conduire à un aspect plus intense sur les images pondérées T1. La localisation est habituellement dans l’angle cardio–phrénique droit (2/3 des cas). Ils sont rarement pédonculés. Parfois la formation peut-être indiscernable d’un kyste bronchogénique ou thymique si la localisation est inhabituelle.
 |
 |
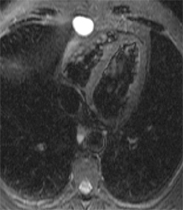 |
Exemple de petit kyste pleuropéricardique de l’angle cardio-phrénique droit avec aspect typique en hyposignal T1 (image de gauche) et en hypersignal T2 (séquence STIR, à droite)
AGENESIE DU PERICARDE
L’agénésie péricardique, affection congénitale très rare, partielle (plutot à gauche) ou totale, entrainant volontier une lévorotation du cœur et pouvant se réveler par des symptômes liés au phénomène de hernie ou de protrusion cardiaque hors du sac péricardique (par exemple manifestations angineuses liées à la compression d’une artère coronaire – cf: Rusk 1999 [1]). Le signe principal est l’interruption nette du liséré péricardique (cf: Axel 2004 [2])
LESIONS TRAUMATIQUES DU PERICARDE
Avec ou sans effraction thoraciques, elles s’accompagnent généralement d’hémopéricarde et sont exceptionnellement du ressort de l’IRM compte tenu du contexte d’urgence qui conduit plutot à réaliser un scanner thoracique.
Exemples de lésions cardiaques internes causées par des cathéters
Les cathéters centraux sont souvent la cause de formations thrombotiques dans l’oreillette droite. Poussés trop loin, ils peuvent entrainer des LESIONS DE FRICTION comme on peut le voir dans l’illustration ci-dessous. Dans cet exemple, la lésion pariétale de l’OD a été découverte lors du bilan étiologique d’un épanchement péricardique. L’extrémité d’un cathéter de dérivation ventriculo-atrial (implanté en raison d’une malformation de Chiari chez une patiente de 35 ans) vient ici frotter le fond de l’OD et entraine une abondante extrasystolie ventriculaire (compliquant fortement l’examen IRM).
Exemples de lésions cardiaques internes causées par une sonde de pacemaker
Les pacemaker et les défibrillateurs implantables restent des contre-indications classiques pour l’examen IRM mais le scanner est une excellent alternative dans ces situations difficiles où l’examen échographique et la radiographie standard ne permettent pas de conclure.
Perforation iatrogène de l’oreillette droite, sous l’auricule, par une sonde de stimulation auriculaire implantée 3 semaines auparavant, qui remonte dans le recessus antéro-supérieur (flèche verte). Epanchement péricardique modéré en postérieur (flèche rouge). Bonne évolution après ablation chirurgicale du matériel.
DIAGNOSTIC DIFFERENTIEL AVEC DES STRUCTURES PARACARDIAQUES
Scissures pleurales :
 |
feuillet pleural remanié paracardiaque droit antérieur |
Péricardiques/Epaississement/Points clés
A retenir :
– Le péricarde est épaissi s’il dépasse 4 mm en echo de spin, de topographie circonférentielle ou localisée.
– Epaississement = hyposignal T1 et hyposignal en écho de gradient ciné (vs hypersignal en ciné si épanchement).
– L’IRM ne permet pas de distinguer fibrose vs calcifications, contrairement au scanner, qui est crucial dans ce domaine.
– Ne pas confondre épaississement (anatomie) et constriction (physiopathologie).
– Signes de constriction = 1) non compliance de la VCI en inspiration et 2) couplage ventriculaire pathologique.
– L’existence d’un couplage ventriculaire pathologique fait le diagnostic differentiel avec une cardiomyopathie restrictive.
L’IRM est considéré comme une indication de classe II dans cette pathologie par le groupe de travail de la Société Européenne de Cardiologie (Europ H J 2004, 25, 1940-65 [1] ) mais cette classification a été établie avant la description du couplage ventriculaire pathologique par Bogaert ([2],[3]) , qui renforce le rôle de l’IRM.