L’étude de la fonction diastolique est un sujet complexe, dominé par l’échocardiographie doppler et où l’IRM n’occupe pas aujourd’hui une place opérationnelle. Nous rappelons ici les principes de base relatifs à l’appréciation du remplissage VG ainsi que les approches envisageables en IRM.
Principes généraux d’étude du remplissage ventriculaire gauche
Le remplissage du VG est lié à deux propriétés du myocarde (Abergel, échocardiographie clinique de l’adulte, édition ESTEM 2003, p256-89):
– la relaxation VG, processus actif comportant la fin de l’éjection, le remplissage isovolumique et le remplissage rapide. Elle dépend surtout de conditions de charge (pressions).
– la diastole proprement dite, dépendant de la distension passive du VG (compliance).
Les anomalies de remplissage entrainent des problèmes pratiques importants puisque l’insuffisance cardiaque à fonction systolique preservée (FEVG > 45%) est fréquente chez le sujet agé et concernerait environ un tiers des insuffisants cardiaques.
En pratique clinique, la question n’est pas tant de détailler le mécanisme de la dysfonction diastolique mais surtout de définir s’il existe une élévation des pressions de remplissage du VG car cela aura une incidence très concrète sur la conduite thérapeutique, en incitant généralement à augmenter le traitement diurétique.
 |
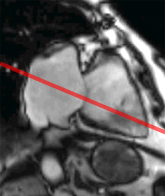
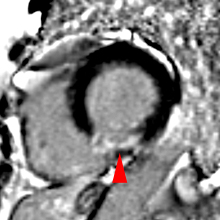
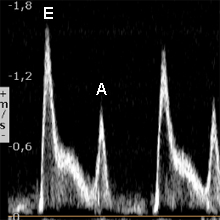
Le remplissage ventriculaire gauche s’apprécie en échographie doppler pulsé, en mesurant le flux transmitral en incidence 4 cavités, au sommet de l’entonnoir mitral comme l’indique le schéma ci-contre.La courbe de flux mitral ainsi obtenue montre deux pics de vitesse : l’onde E correspondant au remplissage rapide initial et l’onde A correspondant au remplissage tardif sous l’impulsion de la systole auriculaire.
L’aspect typique normal chez le sujet de moins de 60 ans comporte une onde E (de l’ordre de 60 à 80 cm/s) plus ample que l’onde A. Le rapport E/A est > 1. |
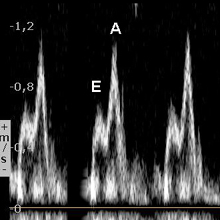
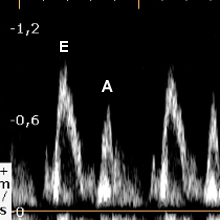
Le tableau ci-dessous résume les principaux aspects décrits par Appleton 1988 [1] et observés après 60 ans et en pathologie.
| Troubles banals de relaxation |
Aspect ‘pseudo-normal’ |
Aspect restrictif |
 |
 |
 |
| E/A < 1 |
1<E/A<2 |
E/A>2 |
| Pression de remplissage normale |
Pression de remplissage à voir selon DTI |
Pression de remplissage élevée |
Le point pratique important à connaitre est la pression de remplissage du VG. La courbe de flux transmitral indique généralement des pressions de remplissage normales lorsque E/A<1 (troubles de relaxation) et des pressions généralement élevées lorsque E/A>2 (profil restrictif).
En cas de profil ‘pseudo-normal’ on ne peut pas conclure sur les pressions et il est alors nécessaire d’enregistrer la vitesse de déplacement de l’anneau mitral avec le doppler tissulaire (DTI – cf: voir ci-dessous) pour discriminer entre pressions de remplissage normales ou élevées (cf: Nageh 1997 [2] et Ommen 2000 [3]).
 |
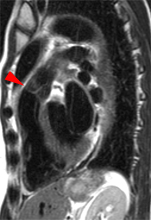
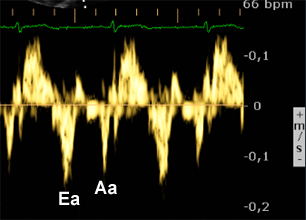 |
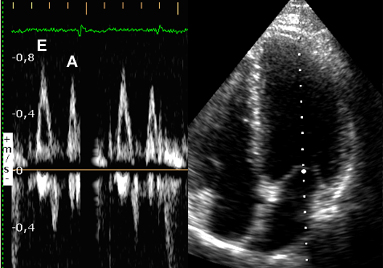
On mesure l’amplitude du déplacement de l’anneau mitral (repères sur l’image de gauche) induit par le remplissage rapide, correspondant à l’onde Ea (N>8 à 10 cm/s) et on fait le rapport E/Ea.Si E/Ea<10, les pressions de remplissage VG sont généralement normales (<12 mmHg), si E/Ea>15, les pressions sont généralement élevées. Entre ces 2 valeurs il existe une zone ‘grise’ et la mesure d’indices complémentaires est alors nécessaire. |
Deux approches possibles du remplissage ventriculaire gauche par IRM
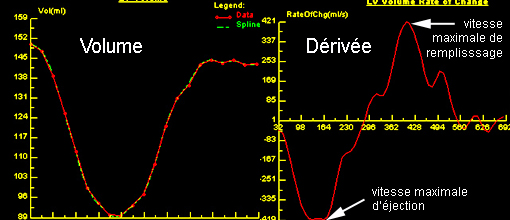
Deux indicateurs – illustrés ci-dessous – ont été proposés pour approcher la fonction de remplissage en IRM ; ils traduisent tous les deux la vitesse avec laquelle le sang entre dans le VG.
Les mesures effectuées à partir de la dérivée de la courbe de volume VG (volumétrie) et à partir des vitesses transmitrales (par cartographie des flux) devraient en principe contenir la même information et devraient correspondre à la courbe du flux transmitral mesurée en doppler. Remarquons d’ailleurs que les mesures IRM de vrai volume VG (sans modélisation) ou de vrai flux transmitral (et non pas de vitesse echantillonnée dans un petit volume, au centre de l’anneau mitral) devraient – en théorie – plus fidèlement représenter le remplissage VG que le doppler (dont le volume d’échantillonnage est limité, partiel). Dans la pratique, il faut bien reconnaitre que la mise en oeuvre des méthodes IRM, loin d’être routinière, est exposée à des imperfections techniques, manque de recul et d’évaluation clinique et ne saurait être concurrentielle avec les méthodes doppler qui sont parfaitement connues et maitrisées.
Par volumétrie du VG
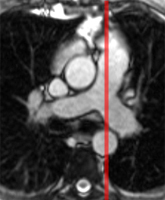
La mesure précise et sans modélisation géométrique du volume VG s’effectue à l’aide d’une pile de coupe couvrant l’ensemble de la cavité (typiquement en incidence petit axe), en contourant l’endocarde sur l’ensemble des images.
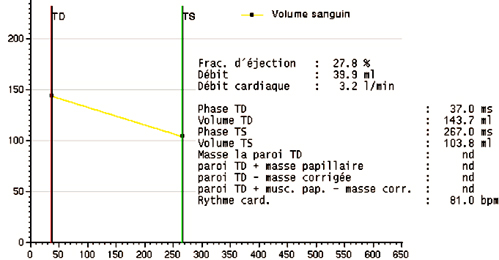
La vitesse maximale de remplissage (peak filling rate), extraite de la courbe de dérivée du volume dans le temps, est un indice utile pour apprécier la fonction diastolique du VG. Cet indice est utilisé depuis les années 1980 en gamma-angiographie isotopique. Les valeurs normales (Bonow 1981 [4]) sont 3,3 ± 0,6 VTD/s (volume télédiastolique par seconde). Une vitesse maximale de remplissage < 2,5 VTD/s est pathologique. Le délai entre l’éjection maximale et la vitesse maximale de remplissage (time to peak filling rate) est également un bon indicateur de la fonction diastolique, qui serait moins sensible aux paramètres que constituent l’age et la FEVG. Sa valeur normale est de 136 ± 23 ms. Une valeur supérieure à 180 ms est pathologique.
Ces indicateurs dérivés de la courbe de volume nécessitent cependant une méthodologie rigoureuse de mesure avec notamment une résolution temporelle qui devrait être < 20 ms et un contourage précis de toutes les coupes à tous les instants du cycle cardiaque et veillant à ne pas effectuer une exclusion brusque de la coupe systolique basale sur la pile de coupes petit axe (ce qui entrainerait une discontinuité dans la courbe de volume et donc fausserait la dérivée !). C’est pourquoi cette méthode d’étude du remplissage VG n’est pas aisée à mettre en oeuvre de manière routinière en IRM.
Par fluximétrie transmitrale
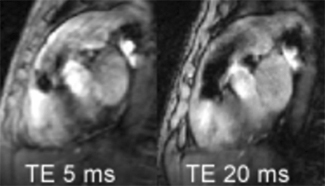
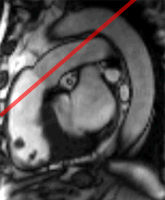
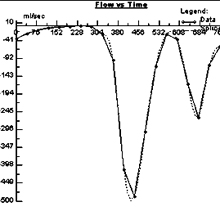
La mesure du flux transmitral peut se faire par cartographie des flux ‘through plane’ selon le principe exposé dans le chapitre sur les valvulopathies, en choisissant un plan de coupe en double obliquité passant par l’anneau mitral.
Sur la courbe de flux (à droite), on retrouve l’onde E (remplissage initial rapide) et l’onde A (correpondant à la systole auriculaire), décrites ci-dessus pour le doppler. Les profils d’écoulement décrits par Appleton (voir supra) peuvent etre retrouvés comme en doppler. Notons qu’il s’agit ici d’un vrai flux et non pas d’une vitesse echantillonnée au centre de l’anneau mitral comme avec le doppler.
Les difficultés pratiques pour cette approche sont multiples. 1) la résolution temporelle est médiocre avec les séquences en apnée (50 ms). Les séquences en respiration libre autorisent une meilleure résolution temporelle mais sont sujettes à des artefacts de flou cinétique lié à la respiration. 2) l’anneau mitral effectue des mouvements considérables d’entrée et de sortie à travers le plan de coupe fixe prescrit pour l’IRM. Ainsi, n’est ce pas exactement la même section d’écoulement que l’on mesure à chaque instant du cycle cardiaque, ce qui introduit un biais dans la mesure du flux transmitral.
En toute hypothèse, si l’on considère que la principale préoccupation du clinicien est d’estimer la pression de remplissage du VG, l’interprétation de cette courbe de flux transmitral est d’un intérêt limité tant que l’on ne dispose pas également de la courbe de déplacement de l’anneau mitral (cf: voir explications ci-dessus relatives au doppler). L’IRM montre certes très bien le déplacement de l’anneau mitral mais la mesure de la vitesse de déplacement de l’anneau mitral ne peut pas être aisément extraite des images, ce qui contraste avec la facilité de mise en oeuvre du DTI en écho-doppler.
Au total, si l’IRM est assurément l’outil d’excellence d’évaluation des volumes et de la fonction systolique, malgré des atouts potentiels (recherche) son intérêt pratique pour l’étude de la fonction de remplissage est très limité comparativement aux bénéfices apportés en routine clinique par l’écho-doppler.