Le rétrécissement valvulaire aortique correspond à un obstacle gênant l’éjection du sang en systole et entrainant un gradient de pression entre le VG et l’aorte en raison de la réduction de la surface d’ouverture valvulaire.
L’étiologie principale de la sténose aortique est la dégénérescence fibro-calcifiée apparaissant avec l’age. La bicuspidie (cf: cliché ci-contre) est une condition qui favorise fortement cette évolution. Le rhumatisme articulaire peut également entrainer une sténose aortique et il existe des formes de sténose aortique congénitale, n’étant parfois détectées que tardivement chez l’adulte.
Aspect morphologique
Comme pour l’insuffisance aortique, épaississements valvulaires et bicuspidie peuvent être assez bien objectivés par l’IRM mais les calcifications ne sont pas directement identifiables.
Exemple de sténose aortique moyennement serrée (1 cm2), sans bicuspidie :
Coupe frontale en ciné SSFP montrant un jet pathologique de perte de signal systolique dans l’aorte ascendante. Coupe ‘5 cavités’ montrant une hypertrophie concentrique du VG et une faible amplitide d’ouverture des sigmoides aortiques. Coupe orientée sur le plan des valves aortiques, montrant 3 cusps avec peu de calcifications mais faible ouverture systolique. En cas de sténose aortique congénitale, chez les jeunes patients, la valve peut apparaitre comme un dôme percé sans qu’il soit possible d’identifier les feuillets valvulaires.
Quantification de surface valvulaire et de gradient par IRM
Deux indices permettent d’apprécier la sévérite du rétrécissement aortique : la surface d’ouverture de la valve et le gradient systolique.
Surface valvulaire
La surface valvulaire peut-être planimétrée de manière directe si le plan de coupe passe correctement, de manière homogène, sur les bords libres des valves en systole (plusieurs acquisitions successives, en replacant finement le plan de coupe ‘de proche en proche’, sont requises pour cela). Cette méthode a été validées (Friedrich 2002 [1]) comparativement à l’écho-doppler (équation de continuité) et au cathéterisme (méthode de Gorlin), avec une tendance à la surestimation de la surface aortique (Debl 2005 [2]) . Cette méthode est considérée comme une alternative valable à l’écho-doppler lorsque cet examen n’est pas concluant (John 2003 [3], Kupfahl 2004 [4]) mais sa mise en oeuvre exige un positionnement précis du plan de coupe (cf: avec les réserves similaires à celles déja évoquées précédemment pour le rétrécissement mitral).
Cartographie de flux
La cartographie de flux est l’autre méthode utilisable pour calculer le gradient aortique (Eichenberg 1993 [5]) ainsi que la surface aortique fonctionnelle, en utilisant l’équation de continuité (Caruthers 2003 [6]), comme en écho-doppler. Selon cette formule, connaissant la surface (S1) de la chambre de chasse de VG (déterminée à partir de son diamètre) et les intégrales temps-vitesse au niveau de la chambre de chasse du VG (VTI1) et au niveau de la sténose aortique (VTI2), la surface aortique S2 = (S1.VTI1)/VTT2.
Sténose aortique sur valve bicuspide assez fortement calcifiée au niveau de sa comissure postérieure (zones noires sur l’image de droite). La troisième image en partant de la gauche montre une cartographie de flux ‘in-plane’ en incidence parasternale grand axe, enfilant le jet accéléré de sténose aortique. Avec un encodage en vitesse à 3 m/s appliqué dans le sens cranio-caudal, une petite zone d’aliasing (tache systolique noire au dessus du plan aortique) apparait dans le flux aortique blanc en systole. D’après l’équation de Bernouilli simplifiée (G=4.V.V, avec G en mmHg et V en m/s), on peut en déduire que le gradient systolique aortique est au moins égal à 4.3.3=36 mmHg.
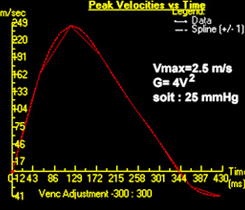
Sténose aortique peu serrée sur valves encore souples chez une patiente présentant surtout un rétrécissement mitral avec forte dilatation de l’oreillette gauche. La planimétrie directe de la surface d’ouverture des sigmoides aortique indique ici 1,2 cm2. La cartographie de flux ‘through-plane’ réalisée juste au-dessus du plan aortique indique une vitesse systolique maximale de 2,5 m/s, soit un gradient maximal de l’ordre de 25 mmHg.
L’HVG entrainée par la sténose aortique entraine des lésions de fibrose myocardique focale (sans signature clinique ni électrique), chez 32.5% des cas d’apres l’étude de Nassenstein 2009 [7] (40 patients sans atteinte coronaire dont la surface aortique était de 0.9±0.2 cm2). L’atteinte prédomine au septum basal et en inférieur et n’est pas de type ischémique car elle épargne les couches sous endocardiques. Elle s’associe à une masse VG accrue et à une FEVG moins bonne que chez les patients sans lésions fibreuse.
Au total: L’IRM est valable pour détecter une bicuspidie et en complément de quantification d’une sténose aortique
Critères classiques de sévérité de la sténose aortique (cf: inspiré de Klimczak [8]) ECHO IRM HVG +++ +++ Réduction de l’ouverture des sigmoïdes < 8 mm ++ ++ Surface aortique < 0,7 ou 0,8 cm2 +++ ++ Gradient de presion maxi > 90 mmHg, gradient moyen > 50 mmHg +++ ++
-
Article suivant
CM restrictive vs péricardite constrictive - Article precedent
Péricarde/Epaississement/Constriction