Objectifs des textes sur les ‘Appropriateness Criteria’
Les textes relatifs aux ‘Appropriateness Criteria’ (que nous traduirons par critères de bonnes indications) ont été publiés depuis 2005 par l’American College of Cardiology Foundation [1] pour tenter de palier à un manque de rigueur quant aux choix des méthodes diagnostiques actuellement prescrites. Les techniques de diagnostic ont beaucoup progressé ces dernières années (les couts en imagerie ont présenté une croissance supérieure à celle des autres dépenses de santé) et sont parfois sur-utilisées, ce qui soulève la question de leur véritable utilité aux yeux des organismes payeurs, des législateurs, des médecins et des patients.
Auparavant, le caractère bien approprié des soins était du seul ressort du prescripteur, de son intuition et de ses dernières observations individuelles. Les propositions sur les critères de bonnes indications visent à rationaliser et à harmoniser ces prescriptions. Elles énumèrent ce qui constitue un usage raisonnable des soins, tout en respectant les recommandations des sociétés savantes,
– pour les médecins, afin de traiter efficacement et de manière responsable leurs patients,
– pour les organismes payeurs envers lesquels ces propositions se veulent des guides, soucieux des économies de santé,
– pour les enseignants, qui sont invités à utiliser ces propositions comme outils d’éducation,
– pour les patients, dans le but de prodiguer des soins de qualité, équitables et transparents.
Les auteurs insistent néanmoins sur le fait que ces textes ne prétendent pas être strictement normatifs et que le clinicien doit toujours pouvoir transgresser, en plus ou en moins, ces critères de bonnes indications, en fonction de son jugement, face au cas particulier posé par chaque patient.
L’établissement des ces ‘critères de bonnes indications’ est basé sur une méthodologie standardisée (Delphi-RAND/UCLA, en deux tours de vote), en combinant les preuves scientifiques et l’expérience pratique, par des experts cliniques de l’ACC et d’autres sociétés savantes, provenant d’horizons variés, qui attribuent pour diverses situations cliniques un score, allant de 1 à 9, stratifiant le caractère approprié pour réaliser tel ou tel examen complémentaire :
– scores de 1 à 3 pour les indications non appropriées,
– scores de 4 à 6 pour les indications dont le caractère approprié est possible mais incertain,
– scores de 7 à 9 pour les indications appropriées.
Approprié = apportant un supplément d’information qui combiné avec le jugement clinique surpasse nettement les inconvénients potentiels de la procédure. Il est à noter que ces textes, dans leur état actuel, même s’ils se veulent soucieux des économie de santé (en tenant compte implicitement du cout des examens avant de leur attribuer un score), ne reposent pas explicitement sur des considérations de cout (cost-effectiveness).
Quelles différences avec les recommandations (guidelines) ?
– les guidelines colligent et résument les preuves et les pratiques optimales basées sur des essais cliniques et des procédures en pointe visant à améliorer le devenir des patients.
– les critères de bonnes indications se veulent plus pragmatiques. Ils pèsent les avantages et les risques des examens pour chaque indication afin de déterminer si un test est raisonnable dans telle ou telle situation, dans le but de prodiguer une bonne qualité des soins.
Au début 2009, il existe 4 textes (appelés à être mis à jour) sur les ‘Appropriateness Criteria’, concernant l’échographie de stress (JACC 2008 [2]), l’ETO, la scintigraphie myocardique (JACC 2005 [3]) et IRM/scanner cardiaque (JACC 2006 [4]).
Maladie coronaire
La maladie coronaire occupe une place centrale dans ces indications pour l’échographie de stress, la scintigraphie, l’IRM et le scanner qui ont donc été regroupés dans les tableaux ci-dessous. Il convient toutefois de noter que la rédaction des textes n’a pas été réalisée de manière uniforme, par une même équipe mais séparément et à des dates différentes selon les modalités d’imagerie.
De surcroit, dans l’article consacré au scanner et à l’IRM cardiaque, les auteurs indiquent clairement que les scores ne doivent pas être comparés entre les différentes modalités d’examen et que l’attribution d’un score par le comité pour une technique ne devait pas se faire par comparaison avec les performances d’une autre technique (ce qui constitue tout de même une limitation de ces textes compte tenu de leur objectif de proposer des outils pratiques et opérationnels pour guider le choix d’un examen complémentaire). L’appréciation de la pertinence d’un examen est basée sur les performances intrinsèques de la méthode, en considérant que le respect des bonnes conditions d’examen (par exemple éviter la prescription d’un coro-scanner en cas d’arythmie) et une exécution techniquement correcte de la procédure sont respectés.
C’est pourquoi quelques discordances peuvent être observées (notamment absence d’attribution de score, correspondant à des cases vides dans les tableaux ci-dessous). Lorsque les scores d’indication sont proches entre différentes méthodes diagnostiques (par exemple pour la recherche d’ischémie), ont peut considérer que le choix de telle ou telle modalité d’examen doit se faire sur des critères pratiques correspondant aux délais de rendez vous, à l’expérience et à la fiabilité des équipes locales, car il n’y a pas – sur le plan des performances diagnostiques comme sur celui des avantages médico-économiques – de méthode nettement supérieure à une autre. La prise en compte du caractère irradiant ou non de l’examen peut également constituer alors un élément du choix. En général, seuls les scores pertinents (>6) ont été rapportés ici dans les tableaux.
La recherche d’une ischémie myocardique comme argument en faveur d’un éventuel geste de revascularisation est au centre des recommandations relatives à la maladie coronaire. L’algorithme de choix des examens appropriés stratifie deux classes d’indications en fonction de :
– la probabilité ‘a priori’ de sténose coronaire pour les patients symptomatiques,
– l’estimation du risque coronaire selon Framingham pour les patients asymptomatiques (voir infra).
La probabilité a priori de sténose coronaire (référence = coronarographie) est définie par le tableau ci-contre, en fonction de l’age et de la catégorie des douleurs thoraciques :
-typique, comportant 3 critères : 1) rétrosternale, 2) à l’effort et 3) cédant sous trinitine.
– atypique avec 2 de ces 3 caractéristiques.
– non angineuse (non ang.) avec une seule ou aucune de ces 3 caractéristiques. |
| Age |
Non ang. Homme |
Non ang. Femme |
Atypique Homme |
Atypique Femme |
Typique Homme |
Typique Femme |
| 30-39 |
4 |
2 |
34 |
12 |
76 |
26 |
| 40-49 |
13 |
3 |
51 |
22 |
87 |
55 |
| 50-59 |
20 |
7 |
65 |
31 |
93 |
73 |
| 60-69 |
27 |
14 |
72 |
51 |
94 |
86 |
|
La probabilité est considérée comme faible si < 10%, intermédiaire entre 10 et 90% et forte au-delà de 90%.
Pour le diagnostic de la maladie coronaire, on considère dans le tableau ci-dessous :
– Echographie de stress (dobutamine) : détection d’anomalies de contraction segmentaire.
– SPECT (adénosine, dipyridamole ou effort) : detection de defect de perfusion.
– IRM de perfusion au premier passage de gadolinium (dipyridamole ou adénosine) : retard de perfusion segmentaire.
– Ciné-IRM sous doses progressives de dobutamine : mise en évidence d’anomalie de la contraction segmentaire.
– Coro-scanner : mise en évidence de sténose(s) coronaire(s).
Syndrome douloureux thoracique faisant suspecter une atteinte coronaire
| SPECT |
Echo |
CT |
IRM |
Situation clinique |
proba. pré-test |
|
|
9 |
8 |
Suspicion d’anomalie de naissance des coronaires |
|
| 9 |
9 |
7 |
7 |
ECG ininterprétable ou effort impossible |
intermédiaire |
| 9 |
7 |
|
|
ECG ininterprétable ou effort impossible |
élevé |
| 6,5 |
7 |
7 |
|
ECG ininterprétable ou effort impossible |
faible |
| 7 |
7 |
5 |
4 |
ECG interprétable et effort réalisable |
intermédiaire |
| 8 |
7 |
|
|
ECG interprétable et effort réalisable |
élevé |
|
8 |
8 |
6 |
Autre stress test ininterprétable ou équivoque |
intermédiaire |
| 8 |
8 |
|
|
Bilan d’une défaillance cardiaque |
intermédiaire |
| 9 |
8 |
|
|
Aggravation des symptômes si test ou coro préalables normaux |
|
| 8 |
8 |
6-5 |
2-1 |
Après revascularisation (pontage – PCI) |
|
On peut expliquer les cases vides, soit par manque de certitude des experts pour y répondre, soit par oubli (le SPECT est d’indication évidente en cas d’autre stress test ininterprétable), soit parce que les experts ont considéré qu’il était naturel d’éviter cet examen en première intention (par exemple il est clair que le test d’effort simple passe en priorité par rapport au coro-scanner lorsque l’ECG est interprétable et que le test d’effort est réalisable ; de même l’échographie de stress n’est pas intéressante pour identifier une anomalie de naissance des coronaires)…
On remarque que la meilleure indication – logique – de ces tests concerne la situation où le test d’effort de base ne peut pas être réalisé ou lorsque l’ECG est ininterprétable (par exemple BBG ou stimulateur cardiaque). C’est ce que l’on peut résumer dans le diagramme ci-dessous – qui ne fait pas partie des ‘Appropriateness criteria’ -, moins complet et moins formel que la liste des critères de bonnes indications mais d’interprétation plus facile et plus immédiate.
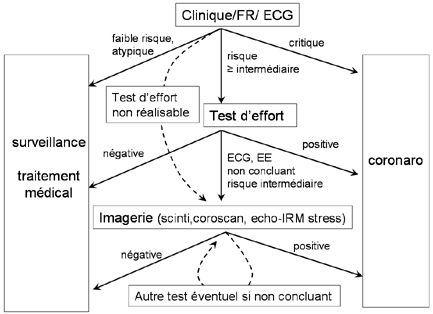 |
Le jugement clinique reste au centre de la démarche (on ne traite pas une image mais un patient).L’ECG d’effort constitue la deuxième étape, à ne pas court-circuiter, sauf si l’ECG est ininterprétable ou si l’effort est impossible.
En aval, 4 modalités d’imagerie non invasive sont en concurrence. La scintigraphie myocardique est la méthode classique d’imagerie non invasive. Echo (ou IRM) de stress et coro-scanner se développent comme méthodes alternatives. Il n’y a pas de différence importante quant aux performances diagnostiques de ces techniques (sensibilité et spécificité de l’ordre de 80%, ou mieux). Dans l’optique d’un éventuel geste de revascularisation secondaire, la recherche d’une preuve ischémique présente un avantage par rapport à la seule anatomie coronaire (sténose). |
Douleurs aigues faisant suspecter une atteinte coronaire
| SPECT |
Echo |
CT |
IRM |
Situation clinique |
proba. pré-test |
| 9 |
8 |
7 |
6 |
ECG et enzymes négatifs |
intermédiaire |
|
|
6 |
|
ECG et enzymes négatifs |
forte |
|
|
|
8 |
Tableau de SCA avec troponine + et coronaro normale |
|
| 8,5 |
8 |
|
|
NSTEMI à faible risque non programmé pour une coro rapprochée |
|
|
|
5 |
|
ECG et enzymes négatifs |
faible |
|
|
4 |
|
‘Triple rule out’ : exclure EP, atteinte coronaire et Dissect. Ao. |
intermédiaire |
Patients asymptomatiques
Concernant les patients asymptomatiques, les indications doivent prendre en compte le risque cardio-vasculaire global sur 10 ans (cf: Grundy 1999 [5]) établi selon les études de Framingham (Anderson, Kanell 1991 [6]). Ce risque cardiaque global est calculé en fonction des facteurs de risque cardio-vasculaires classiques : âge, sexe, tension artérielle systolique, cholestérol total et sa fraction HDL, diabète, tabagisme et HVG électrique éventuels.
Les évènements pris en compte comportent le décès de cause cardiaque, l’infarctus non fatal, une coronaropathie avérée un AVC ou un angor. Le risque est dit faible en deçà de 10% d’évènements CV sur 10 ans, intermédiaire entre 10 et 20% et élevé au-delà de 20%. Il est intéressant de comparer ce niveau de risque CV global avec le risque de décès de cause CV (qui est environ 10 fois moindre). Si l’on se réfère à l’étude SCORE de l’ESC [7] , [8], un risque faible correspond à une mortalité de moins de 1 à 2 % (vs risque CV global de 10%) et un risque élevé correspond à une mortalité > 5% (vs risque global de 20%). Les abaques de calculs sont disponibles notamment dans les articles sur les ‘Appropriateness Criteria’ [9] et sur le site de l’étude de Framingham [10]. Des outils de calcul en ligne sont accessibles sur le site de la faculté de Jussieu [11].
Une récente actualisation des risques CV selon Framingham a été publiée par d’Agostino et al (Circulation 2008 [12]), en tenant compte du fait que le patient soit ou non traité pour une HTA. Le calcul est disponible sur cardiorisk.fr [13]. Il importe de savoir que le risque pronostic calculé pour une population américaine est très différent dans d’autres régions du monde. Ainsi, en Espagne, le risque est presque 3 fois moins élevé chez l’homme et presque 2 fois moins élevé chez la femme (Marrugat 2003 [14]) alors même que la prévalence des facteurs de risque traditionnels est similaire à celle observée dans la région de Framingham. En France, les travaux de Laurier 1994 [15], de Vergnaud 2008 [16] et Empana 2003 [17] ont montré qu’il convient de diviser par 2 le score de risque de Framingham pour s’adapter à la population française.
| SPECT |
Echo |
CT |
IRM |
Situation clinique |
Risque Framing. |
| 7,5 |
7 |
7 |
7 |
Bilan étiologique d’une défaillance cardiaque |
modéré |
| 8-9 |
7 |
|
|
Bilan étiologique d’une TACFA ou d’une TV |
discuté |
| 7-8 |
3-6 |
|
|
Evaluation coronaire en particulier dans les professions à risque (*) |
discuté |
| 8 |
7 |
4 |
6 |
Pré-op avec risque chirurgical intermédiaire et tolérance effort < 4 METS |
intermédiaire |
| 8 |
8 |
|
|
Pré-op avec risque chirurgical élevé et tolérance effort < 4 METS |
|
| 7,5 |
6 |
2-3 |
|
Contrôle de pontage de plus de 5 ans (**) |
|
| 9 |
|
|
|
Test d’effort traduisant une probabilité post-test intermédiaire |
intermédiaire |
| 9 |
|
5 |
8 |
Fonction VG après défaillance cardiaque IDM, si écho. problématique |
|
|
7 |
4 |
|
Agatston > 400 au calcium scoring CT |
intermédiaire |
Pour certaines indications, quelques discordances peuvent être observées quant au risque de Framingham à prendre en compte. Par ailleurs, ce tableau ne prend pas en compte le détail des indications concernant 2 situations pour SPECT et échographie de stress : D’une part, la détection de l’insuffisance coronaire chez les patients asymptomatiques à haut risque (*) et chez les patients travaillant dans des métiers à haut risque (pilotes…), d’autre part le suivi des patients revascularisés asymptomatiques (**) en fonction du délai (2 ou 5 ans) et selon qu’ils présentaient ou non des symptômes avant leur revascularisation.
Sténoses coronaires de signification douteuse et post-IDM
| SPECT |
Echo |
CT |
IRM |
Situation clinique |
| 8 |
|
|
|
STEMI stabilisés traité par thrombolyse et coronarographie non programmée |
|
|
|
7 |
Localisation et étendue de l’IDM (et du no-reflow) |
| 8,5 |
8 |
|
9 |
Bilan de viabilité avant revascularisation éventuelle |
| 9 |
8 |
|
7 |
Sténose coronaire de signification équivoque |
Autres indications, en dehors de la maladie coronaire
| SPECT |
Echo |
CT |
IRM |
Situation clinique |
| 9 |
|
|
8 |
Quantification de la fonction cardiaque si échocardiographie insatisfaisante ou si discordance |
|
|
|
8 |
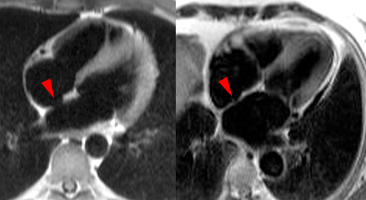
Suspicion de myocardite |
|
|
|
8 |
Evaluation des cardiomyopathies spécifiques (avec gadolinium) |
|
|
|
9 |
Suspicion de dysplasie arythmogène du VD après syncope ou TV |
|
|
7 |
9 |
Cardiopathies congénitales complexes |
|
|
5 |
8 |
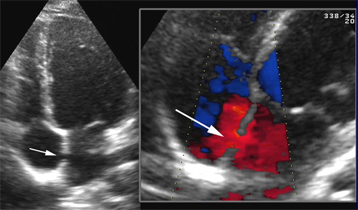
Analyse des valves ou prothèses valvulaires si ETO limité |
|
|
8 |
9 |
Analyse de masse cardiaque si autre technique limitée |
|
|
8 |
8 |
Analyse péricardique si autre technique limitée |
|
|
8 |
8 |
Cartographie des veines pulmonaires avant radio-ablation de FA |
|
|
8 |
|
Cartographie coronaire et mammaire avant chir. redux de revascularisation |
|
|
9 |
8 |
Suspicion de dissection aortique ou d’anévrysme de l’aorte thoracique |
|
8-7 |
|
|
Sténose aortique équivoque (dobu) – IM et IA asymptomatiques sévères |